目的:研究超声引导下经腹腔途径经皮肾镜碎石取石术治疗移植肾肾结石的临床疗效。方法:回顾性分析2018年7月至2022年9月收治的10例移植肾结石患者的临床资料。男7例,女3例,年龄41~76(54.30±12.13)岁。右侧移植肾结石6例,左侧移植肾结石4例。单发肾盂结石3例,单发肾盂输尿管连接部结石1例,多发结石6例,主体结石均位于肾盂。结石最大径(2.08±0.51)cm。结石CT值(1364.60±194.11)Hu。10例患者均在全麻状态下,行超声引导下经腹腔途径经皮肾镜碎石取石术。结合术前CTU资料,在超声引导下寻找移植肾穿刺点并建立适当大小穿刺通道。建立3例Fr20、5例Fr18、2例Fr16通道,用钬激光击碎结石。观察并记录结石清除情况、手术时间、术前术后检验指标、术后并发症等。结果:10例患者均顺利通过一期手术并清除结石。手术时间(59.80±6.46)min。术后住院时间(5.60±0.70)d。无脓毒血症、持续性疼痛、术中输血、肠管及肠系膜血管损伤发生。1例患者术后出现肌酐升高,3d后恢复正常。术后3d复查彩超和1个月复查CT平扫均未见结石残余,顺利拔出双J管。患者在随访的3个月至1年期间,复查均未见结石复发,肾功能正常。结论:超声引导下经腹腔途径经皮肾镜碎石取石术治疗移植肾肾结石具有安全、有效的特点。
Objective: To investigate the clinical efficacy of ultrasound-guided peritoneal transperitoneal nephroscopic lithotripsy for the treatment of kidney graft stone.Methods: The clinical data of 10 patients with kidney graft calculi treated between July 2018 and September 2022 were retrospectively reviewed.There were 7 males and 3 females with ages ranging from 41-76(54.30 ± 12.13) years.Right kidney graft calculi were present in 6 cases and left kidney graft calculi in 4.There were 3 single pelvic calculi, 1 single ureteral junction calculi, and 6 multiple pelvic calculi, all of which were located in the renal pelvis.The maximum calculi diameter was (2.08 ± 0.51) cm.Calculi CT values were (1364.60±194.11)Hu.Results: All 10 patients underwent transperitoneal percutaneous nephroscopic lithotripsy guided by ultrasound under general anesthesia.Under ultrasound guidance in combination with preoperative CTU, graft puncture sites were determined and appropriate size puncture channels were established.Three Fr 20, five Fr18 and two Fr16 channels were constructed, and calculi fragmentation was performed with holium laser.Calculi-free status, operative time, preoperative postoperative parameters, postoperative complications were observed and recorded.All 10 patients had successful primary surgery and calculi-free procedure.Surgical duration was (59.80±6.46) min.Postoperative hospital stay was(5.60 ± 0.70 )d.There were no sepsis, persistent pain, intraoperative blood transfusion, intestinal duct and mesenteric vascular injury.One patient showed elevated creatinine after operation, which returned to normal after 3 days.After 3 days of surgery, neither color ultrasound nor 1-month repeat computed tomography showed calculi residue, and two J tubes were successfully removed.During the 3-month to 1-year follow-up period,no calculi recurrence occurred and renal function was normal.Conclusion: Ultrasound-guided peritoneal transperitoneal nephroscopic lithotripsy for the treatment of kidney graft calculi is safe and effective.
随着肾移植技术的发展, 接受肾移植患者逐年增加, 移植肾结石病例也逐渐增多。依据文献报道, 移植肾结石发病率为0.2%~1.8%[1, 2]。移植肾是功能性孤立肾, 处于无神经状态[3]。经皮肾镜碎石取石术(percutaneous nephrolithotomy, PCNL)作为一种微创技术, 被广泛应用于上尿路结石的治疗, 是复杂性肾结石的一线治疗方法[4, 5]。2018年7月至2022年1月我院采用超声引导下经腹腔途径PCNL治疗移植肾结石患者, 效果满意。本研究将总结我院采用超声引导下经腹腔途径PCNL治疗移植肾结石的经验。
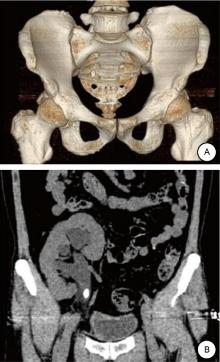
回顾性分析我院2018年7月至2022年9月收治的10例移植肾结石患者的临床资料。男7例, 女3例, 年龄41~76(54.30± 12.13)岁。右侧移植肾结石6例, 左侧移植肾结石4例。单发肾盂结石3例, 单发肾盂输尿管连接部结石1例, 多发结石6例, 主体结石均位于肾盂。3例因下腹胀痛伴少尿入院, 7例因体检发现移植肾结石入院。10例术前血常规、凝血功能、大便常规、肝功能、电解质均正常。心电图, 胸部X片未见明显异常。另外, 针对10例患者采用B型超声波和泌尿系统CT造影(CT urography, CTU)(图1), 以明确移植肾解剖位置、结石大小及分布情况、集合系统及周围器官是否异常、输尿管有无迂曲、狭窄。尿培养+药敏实验均为阴性, 术前给予经验性抗感染治疗。术前常规检查结果如表1。所有患者均有不同程度的肾积水。S.T.O.N.E.评分分别为6、7、6、8、9、8、8、7、7、6分。本研究遵循的程序符合2013年修订的《世界医学协会赫尔辛基宣言》要求。
| 表1 10例移植肾结石患者的检查结果 ($\bar{x}$± s) |
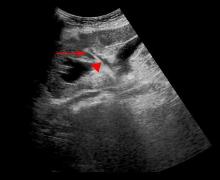
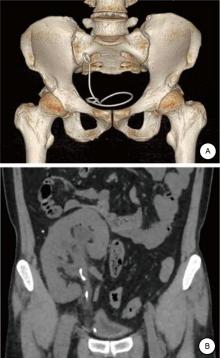
患者在全麻下取截石位, 输尿管镜直视下进入膀胱, 于膀胱患侧见移植肾输尿管开口, 置入Fr 6输尿管导管。改平卧位, 将手术垫垫于患侧腰背部, 通过输尿管导管注入生理盐水形成人工肾积水。结合术前CTU及三维重建, 于患者腹侧在超声探头实时引导下寻找目标穿刺点, 留置U型导丝。7例肾盏朝向腹侧, 基于高效和安全的原则, 选择中组肾盏作为穿刺点, 采用“ 肾盏穹隆-盏颈轴线两步穿刺法” 穿刺[6]。3例肾盂朝向腹侧患者, 无法选择理想的肾盏, 以肾盂作为目标穿刺点。通过超声探头施加一定压力于腹壁, 让移植肾表面尽可能远离肠管。超声实时监测下调整穿刺针方向, 穿刺目标肾盏, 经穿刺针鞘插入斑马导丝(图2), 沿导丝用筋膜扩张器逐步扩张, 建立适宜的经腹腔途径经皮肾通道并留置Peel-away外鞘。医师使用经皮肾镜通过外鞘进入移植肾内, 观察并确定结石位置, 行经皮肾狭窄内切开, 以钬激光碎石并反复冲洗清除结石, 镜检各组肾盏及肾盂无明显残石, 最后采用超声再次确定无残石存留。如果单一经皮肾通道无法清除结石, 可建立多通道。拔出原留置的输尿管导管, 置入导丝, 留置双J管1根, 通过肾镜观察腹腔无血管及肠管损伤后, 再经外鞘留置肾造瘘管。
所有患者手术时间(59.80± 6.46)min, 结石最大径(2.08± 0.51)cm, 一期清石率100%, 住院时间(5.60± 0.70)d, 无严重并发症发生。1例患者术后发热, 温度为38.7℃, 经抗感染等对症治疗后温度降至正常。10例均无脓毒血症、持续性疼痛、术中输血、栓塞。1例患者术后肌酐出现升高, 3d后恢复正常。术后1月复查彩超和CT平扫均未见结石复发, 顺利拔出双J管。患者在随访的3个月至1年期间, 复查均未见结石复发, 肾功能正常。
移植肾肾结石患者是功能性孤立肾, 其边缘化的肾功能, 处于去神经状态, 所以移植肾结石患者临床表现缺乏绞痛的特点, 常有突发少尿或无尿, 部分患者因肾积水引起的腹膜刺激征出现下腹胀痛。本研究中3例因下腹胀痛伴少尿入院, 7例因体检发现移植肾结石入院。超声是最简单、快捷的确诊方法[7]。由于骨盆遮挡, 腹部平片难以显示移植肾结石。移植肾结石最常见的疾病鉴别诊断是急性排斥反应。移植肾结石常无发热和绞痛感, 血压无波动, 超声示移植肾血液供应良好, 集合系统有分离, 他克莫司浓度检测无异常, 使用利尿剂后无反应; 急性排斥反应常有发热、关节及肌肉痛, 移植肾增大和胀痛, 血压升高, 超声示肾动脉搏动和阻力指数升高, 集合系统不分离, 他克莫司检测发现浓度谷值较低, 使用利尿剂后尿量增加。
移植肾患者发生泌尿系结石并不常见, 我院移植科2000年至2022年成功行肾移植手术5788例, 供体肾均未有结石, 移植肾术后结石率为0.17%, 略低于文献报道[1, 2]。形成尿路结石的原因主要有四个方面:⑴解剖学因素:膀胱输尿管反流、部分输尿管梗阻和留置缝合材料[8]。⑵代谢因素:甲状旁腺功能亢进、高尿酸血症、高钙尿症和过度碱性尿[9], 高尿酸血症和高甲状旁腺素血症是肾移植受者中最常见的代谢紊乱[10]。⑶生理因素:肾小管酸中毒和尿路感染。⑷免疫抑制治疗:环孢素是一种钙神经元抑制剂, 与高尿酸血症有关[11, 12]。他克莫司是另一种钙神经元抑制剂, 其优点是不增加尿酸水平[13, 14]。本研究中患者尿酸数值为(262.70± 115.58)μ mol/L, 仅1例为高尿酸血症患者, 尿酸值527μ mol/L, 并且在我们有限的病例中, 没有一个高尿酸血症患者的免疫抑制方案中有环孢素。
移植肾结石患者治疗的原则是保护移植肾功能, 保证尿道排泄通畅。目前来说, 传统治疗泌尿系结石的方法都可以尝试用于移植肾结石患者[15]。Klingler等[16]认为, 除非结石直径≤ 4mm, 否则不应该首选保守治疗。由于移植肾位于盆腔髂窝处, 体外冲击波碎石术(extracorporeal shock wave lithotripsy, ESWL)定位困难, 经验少且冲击波对移植肾功能的损伤不可避免, 故不建议选择ESWL[17]。本研究中结石最大径(2.08± 0.51)cm, 选择经皮肾镜技术作为治疗的主要方法, 具有安全、微创、高效等优点, 在国内外PCNL已经是处理移植肾和输尿管并发症的金标准[18]。Wyatt 等[19]报道的腹腔镜辅助PCNL治疗移植肾肾结石, 平均手术时间为85 min, 一期清石率达81%, 平均住院时间为5.1 d, 无严重并发症发生。此方法有助于提高PCNL对于特殊病例穿刺的安全性, 但手术过程复杂, 手术时间较长。因此, 我们采用超声引导下经腹腔途径PCNL治疗移植肾肾结石, 在超声引导下寻找移植肾穿刺点并建立适当大小穿刺通道。建立3例Fr 20、5例Fr 18、2例Fr 16通道, 但该方法对术者的熟练程度要求较高。所有患者手术时间为(59.80± 6.46)min, 一期清石率达100%, 住院时间(5.60± 0.70)d, 无严重并发症发生。在手术时间和清石率方面, 本研究结果优于Wyatt 等的报道, 住院时间相似。因此, 我们认为基于术者在熟练掌握PCNL的前提下, 本术式安全, 高效, 可作为治疗移植肾肾结石的有效选择。
我们采用超声引导下经腹腔途径PCNL治疗移植肾结石的体会如下:⑴超声可以对肾脏整体进行扫描, 对集合系统和结石位置实时立体构图, 实时监测穿刺针与集合系统的关系, 动态观察移植肾大小、动静脉血流。⑵在不损伤患者移植肾功能的前提下, 术前完善常规CTU检查以提高行PCNL时的安全性[20]。⑶采用超声引导的方式, 辐射量小, 操作简单, 并且在对移植肾结石患者手术时, 超声引导有着X线无法相比的优点, 在穿刺时可以利用超声实时监测皮肤穿刺点到肾脏之间是否存在肠管, 但这个过程主要依靠手术医师的主观判断, 学习曲线较长[21]。⑷对于移植肾结石伴有输尿管迂曲患者, 我们建议在输尿管直视下置入输尿管导管, 在输尿管镜操作前务必排尽空气, 以免影响后续操作。术后直视下退出肾穿刺针鞘, 确保穿刺路径无肠道损伤, 术后双J管的留置可以减少尿瘘的发生率。
综上所述, 超声引导下经腹腔途径PCNL治疗移植肾肾结石具有安全、有效等特点, 可有效避免移植肾周围解剖器官损伤, 值得临床推广应用。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|