目的:探讨三维重建虚拟手术规划技术在零缺血腹腔镜肾部分切除术治疗cT1b期肾肿瘤中的临床应用价值。方法:回顾性分析2018年1月至12月间在上海交通大学医学院附属仁济医院泌尿外科行零缺血腹腔镜肾部分切除术的55例cT1b期肾肿瘤病例,其中三维重建组患者29例,CTA组患者26例。三维重建组患者术前行增强CT并在虚拟手术规划技术平台进行三维重建,并根据重建结果确定肿瘤位置、肿瘤供应血管位置、周围血管分布情况,从而制定手术方案,术中根据术前制定方案行零缺血腹腔镜肾部分切除术。CTA组患者术前常规行肾脏增强CT,并根据增强CT影像行零缺血腹腔镜肾部分切除术。比较三维重建组与CTA组间术中出血量、手术时间、术中及术后并发症情况。结果:本研究55例患者均顺利完成手术,无中转开放或根治手术,无严重并发症发生。两组患者年龄、性别、BMI、肿瘤直径、R.E.N.A.L评分差异无统计学意义( P>0.05)。三维重建组相比CTA组手术时间更短、术中出血量更少,差异具有统计学意义( P<0.05)。所有患者术后病理切缘均为阴性。结论:三维重建虚拟手术规划技术通过术前可视化评估肿瘤、肾脏、血管解剖结构及相对位置,可帮助术者术前合理规划手术方式,在腹腔镜零缺血肾部分切除术中可以有效缩短手术时间,减少术中出血量,具有一定的临床应用价值。
Objective: To investigate the clinical application value of three-dimensional reconstruction virtual surgical planning technology in zero ischemia laparoscopic partial nephrectomy for cT1b stage renal tumors.Methods: The clinical data of 55 patients with cT1b renal tumor who underwent zero-ischemia laparoscopic partial nephrectomy between January to December 2018 were retrospectively analyzed, including 29 patients in the 3D reconstruction group and 26 patients in the CTA group. Patients in the 3D reconstruction group underwent preoperative enhanced CT and 3D reconstruction on the virtual surgical planning technology platform. Tumor location, tumor supply blood vessel location, and surrounding blood vessel distribution were determined according to the reconstruction results, so as to formulate the surgical plan. Laparoscopic partial nephrectomy under zero ischemia circumstance was performed. Patients in the CTA group underwent routine renal enhanced CT before surgery, and underwent zero ischemia laparoscopic partial nephrectomy according to the enhanced CT images. The intraoperative blood loss, operation time, intraoperative and postoperative complications were compared between the three-dimensional reconstruction group and the CTA group.Results: All patients successfully completed the operation without conversion to open surgery or radical nephrectomy, and no serious perioperative complications occurred. There were no significant differences in age, gender distribution, body mass index, tumor diameter and R.E.N.A.L. scores between the two groups ( P>0.05). The 3D reconstruction group had shorter operation time and less intraoperative blood loss than the CTA group (all P<0.05).Conclusion: The 3D reconstruction virtual surgical planning technology can evaluate the anatomical structure and relative positions of tumor, kidney and blood vessels through preoperative visualization, which can help to plan the surgical method reasonably before surgery.
保留肾单位手术(nephron sparing surgery, NSS)能够在完整切除肿瘤并保证肿瘤学疗效的同时保护肾功能, 已成为治疗cT1a期(肿瘤直径≤ 4cm)及部分cT1b期(4cm< 肿瘤直径≤ 7cm)肾肿瘤手术的“ 金标准” [1, 2]。腹腔镜肾部分切除术( laparoscopic partial nephrectomy, LPN)目前已取代传统开放手术, 成为治疗cT1N0M0期肾肿瘤的主流术式[3]。传统LPN需要在切除肿瘤及重建过程中阻断肾动脉主干, 减少创面渗血, 从而创造手术视野。然而, 阻断肾动脉的过程会对肾脏造成热缺血-再灌注损伤, 进而影响术后短期及远期肾功能[4]。因此, 2011年, “ 零缺血” NSS的概念首次被提出, 即在不阻断肾动脉的条件下完成肿瘤切除及创面重建, 该技术有助于减少肾脏缺血-再灌注损伤, 保护肾功能[5]。
然而, 由于cT1b期肾肿瘤的瘤体大、生长方式复杂、血供丰富, 对术野清晰度的要求更高, 如在零缺血条件下进行手术, 往往创面渗血严重, 影响手术操作的准确性和安全性。因此, 零缺血肾部分切除治疗cT1b期肾肿瘤对于大多数泌尿外科医师仍具有一定的挑战性。随着“ 精准医疗” 与“ 智慧医疗” 概念在泌尿生殖系肿瘤治疗领域的推广, 对不同病例解剖结构的个体化认识并制订针对性手术计划具有重要的临床价值。此前研究显示, 相较于传统影像学检查, 全息重建技术对于术者行LPN手术术前读片了解病例特征, 制订手术方案具有一定的优势[6]。目前, 三维重建技术在外科领域快速普及, 已有部分研究探索其在肾脏肿瘤手术中的应用价值[7]。本研究报道了相较传统计算机断层扫描血管造影(computed tomography angiography, CTA), 使用三维重建虚拟手术规划技术指导零缺血LPN治疗cT1b期肾肿瘤的初步经验。
回顾性分析2018年1月至12月间上海交通大学医学院附属仁济医院泌尿外科行零缺血LPN的患者55例。所有患者术前影像学均诊断为cT1bN0M0单发肾脏肿瘤。根据手术指导技术分为三维重建组和CTA组。其中三维重建组患者29例, 男性15例, 女性14例。CTA组患者26例, 男性18例, 女性8例。排除双侧肾肿瘤、孤立肾肿瘤、既往肾脏手术史者。
所有55例患者术前均于我院行64排CTA检查。CT层厚1.25 mm三维重建组患者DICOM格式的CTA影像资料上传至EDDA公司服务技术平台进行三维重建, 并将重建数据下载至电脑及手机客户端。重建影像除了包括常规的正常肾脏、肿瘤、肾脏动静脉、集合系统和输尿管的空间毗邻关系外, 还增加了肿瘤供应血管分布情况。手术医师在术前通过客户端平台阅读重建影像并进行手术规划, 术者在术中根据三维重建结果, 实时匹配术中数据, 指导肿瘤暴露及肿瘤靶血管的处理。
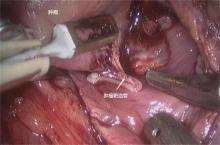
手术均由具有丰富肾脏手术经验的泌尿外科医师完成。手术体位、通道建立均采用常规的经后腹腔LPN方式。成功建立后腹腔空间后, 游离肾周脂肪, 打开Gerota筋膜, 游离肾动脉主干备阻断。CTA组在术前CTA指导下进行零缺血LPN。三维重建组术者根据术前三维重建影像定位, 游离肿瘤周围肾周脂肪, 完全显露肿瘤, 行腹腔镜下“ 球冠状” 肾部分切除术[9]:选择肿瘤与肾实质交界线外3mm处肾脏表面锐性切开肾包膜, 楔形切入肾实质, 直至寻找到肿瘤假包膜与肾实质间过渡带, 沿该层面进行剜除。剜除过程中采用锐性切割与钝性推剥相结合的方式分离肿瘤与肾实质, 如遇出血点, 采用单极电凝或双极电凝进行接触电凝止血。操作过程中, 助手持吸引器间断吸引创面渗血以保持视野清晰。分离至术前重建所见肿瘤供应血管周边时, 减少锐性切割, 以单极电剪刀相应弧度贴合肿瘤包膜表面行钝性推剥, 逐步寻找供应血管。分离至供应血管后, 继续以钝性推剥方式分离血管周围层面, 直至完整暴露血管, 予以Hemolock夹闭后离断(图1)。完整剜除肿瘤, 检查创面, 如有明确集合系统破口, 予以倒刺线缝合, 对明确出血点用3-0倒刺缝线行局部缝合止血。仔细确认创面无明显出血后, 以2-0倒刺缝线单层连续缝合肾实质, Hemolock加压固定, 关闭创面。取出标本, 留置负压吸引。
采用SPSS 20.0统计软件对数据进行分析。计量资料符合正态分布用均数± 标准差 ($\bar{x}$± s) 表示, 组间比较采用t检验。计数资料用例数(百分率)表示, 组间比较采用Fisher精确检验。P< 0.05为差异有统计学意义。
三维重建组年龄(51± 11)岁, BMI (24.4± 1.8)kg/m2, 肿瘤最大径(4.8± 0.6)cm, R.E.N.A.L.评分(8.0± 1.3)分[8]。CTA组年龄(52± 9)岁, BMI (24.3± 2.5)kg/m2, 肿瘤最大径(4.7± 0.6)cm, R.E.N.A.L.评分(8.0± 1.3)分。三维重建组与CTA组在性别、年龄、肿瘤位置、BMI、肿瘤最大径、R.E.N.A.L.评分等各项临床指标比较差异均无统计学意义(P> 0.05)。
55例患者均顺利完成手术, 无中转开放或根治手术, 无严重并发症, 无输血病例。三维重建组中2例因剜除时创面出血明显, 无法清晰显示术野, 术中中转阻断肾动脉主干行肾部分切除术, 热缺血时间分别为8和10 min, 术中出血量分别为200和300 ml; CTA组中有4例中转阻断肾动脉主干行肾部分切除术, 热缺血时间8~11 min, 出血量150~500 ml。三维重建组手术时间和术中出血量均优于CTA组, 差异具有统计学意义(P< 0.05)。
| 表1 两组患者围手术期指标比较 ($\bar{x}$± s) |
两组患者术后病理诊断肾透明细胞癌42例, 血管平滑肌脂肪瘤9例, 乳头状肾细胞癌3例, 嗜酸性细胞腺瘤1例, 所有肿瘤切缘均为阴性。术后随访12~46(36.3± 11.6)个月。CTA组1例术后病理诊断为肾透明细胞癌, Fuhrman分级Ⅲ 级, 术后36个月随访时发现肺部转移, 予以培唑帕尼靶向治疗, 患者目前肿瘤无进展, 1例术后病理诊断为Ⅱ 型乳头状肾细胞癌, 术后随访肿瘤无复发或转移, 术后32个月因食道恶性肿瘤进展死亡; 三维重建组中1例术后诊断为肾透明细胞癌, Fuhrman分级Ⅱ 级, 术后随访肿瘤无复发或转移, 术后20个月死于急性心肌梗死, 其余患者均无肿瘤复发或转移。
传统肾部分切除术中, 术者需阻断肾动脉, 创造相对无血的术野以确保完整切除肿瘤、缝合创面。然而, 肾动脉阻断引起的肾脏热缺血-再灌注损伤会影响术后短期与长期肾功能。既往研究显示, 每分钟热缺血时间都会对远期肾功能造成影响[13]。因此, 国内外诸多学者均对减少热缺血-再灌注损伤进行了研究, 包括术中冰水降温[14]、微波/射频消融辅助肾部分切除术[15, 16]、高选择性肾动脉阻断[17]等。
2011年, Gill团队首次提出“ 零缺血” 肾部分切除术的概念, 意即在切除肿瘤前不阻断肾动脉, 从根本上避免了热缺血时间, 最大程度保护肾功能[5]。然而, 零缺血肾部分切除术的术前准备要求严格, 术中操作难度大, 围手术期并发症发生率高, 既往多用于R.E.N.A.L.评分较低的病例。造成这一现象的原因是, 不阻断肾动脉意味着在切除肿瘤及创面重建过程中, 肾脏持续处于血流正常灌注状态, 存在创面持续出血, 且影响手术视野。因此, 对于肿瘤供应血管的术前明确定位与术中准确控制成为该手术的要点。
CTA是目前肾脏肿瘤术前常用的影像学评估手段, 随着影像学及计算机技术的革新迭代, CTA已经可以准确显示肿瘤瘤体、肾门部血管、肾实质、集合系统和输尿管等结构。然而, CTA无法直观呈现其间的解剖学相对位置关系, 以及肾脏内部分支血管走行情况。此外, CTA所展示的信息仅为二维图像, 需要通过主刀医师丰富的经验和空间想象力, 才能在术中腹腔镜视野下进行定位。因此, 发展更为直观、准确的手术规划辅助技术, 已成为零缺血肾部分切除术开展的关键。
本研究所有三维重建组患者均在完善CTA检查后, 行三维重建。重建图像内容包括经过渲染的半透明肾脏、肿瘤、肾内外脉管系统及集合系统的三维模型, 在临床实践中, 我们发现三维重建在指导零缺血LPN术方面具有以下几项优势:
⑴相较于传统主刀医师通过CTA二维图像获取信息, 并根据自身空间想象力了解肾脏及肿瘤的解剖特征, 三维重建可以更直观地显示肾脏、肿瘤及其周围脉管系统的解剖结构及毗邻关系, 提升主刀医师术前读片获取的信息量。研究显示通过术前阅读三维重建模型, 术者在手术中可以更精准快捷地定位肿瘤, 并在剜除过程中准确控制肿瘤供应血管[18]。在此前的研究中, 我们发现相比传统CTA, 三维重建通过帮助主刀医师精确识别集合系统及肿瘤供应血管, 在确保肿瘤完整切除的前提下, 可以有效缩短手术时长及术中出血量, 且降低术中中转阻断肾动脉主干的可能性。
⑵三维重建可以通过数据分析及重建过程, 了解肿瘤供应血管情况。在零缺血LPN术中, 早期控制肿瘤供应血管, 可以有效减少术中出血量, 并提供较好的手术视野。然而, 在实际操作中, 部分肾肿瘤常伴随1支以上的供应血管, 且血管直径较小, 在术前CTA读片过程中易遗漏[19]。如术中不慎损伤供应血管, 常造成创面大量出血, 即使升高气腹压止血, 效果依然有限, 最终不得不阻断肾动脉主干, 行常规LPN。通过对术前CTA影像进行三维重建, 可以显示肿瘤供应血管的数量及进入瘤体的具体位置, 从而帮助术者早期控制供应血管, 减少术中出血的同时, 提高零缺血LPN的成功率。本研究三维重建组在术中出血方面优于CTA组, 且术中中转阻断肾动脉主干的发生率也低于后者。
⑶三维重建直观显示肿瘤形态, 有助于精准剜除肿瘤, 降低切缘阳性率。此前研究结果显示, 三维重建模型在机器人辅助前列腺癌根治术及肾部分切除术中, 凭借着其直观、清晰、可视化的优势, 可在手术中降低手术标本的切缘阳性率[20]。由于部分肾脏肿瘤可能呈不规则生长或伴有卫星灶, 借助三维重建影像, 主刀医师可在术前评估肿瘤形态及卫星灶情况, 降低切缘阳性率。
此外, 在实际临床工作中, 我们发现三维重建图像不仅有助于术前评估和制订手术方案, 同时由于其直观可视的特性, 也可用于术前患教及谈话, 有助于患者及家属更好地了解病情及手术相关情况。本研究也存在一定的局限性。首先, 由于三维重建虚拟手术规划技术基于术前CTA检查, 因此对于造影剂过敏或肾功能不全, 不适合行CTA的肾脏肿瘤患者, 该技术并不适用; 其次, 本研究纳入病例的平均肿瘤最大径为4.8cm, 而肿瘤直径更大的cT1b期肿瘤病例是否能从该技术中获益, 仍需进一步验证; 第三, 由于技术目前仍存在一定局限性, 暂未实现术中实时同步重建模型与手术视野, 因此该技术在术中实时定位导航的作用仍有欠缺; 此外, 本研究仅提供单中心小样本回顾性经验, 相关结论仍有待进一步高级别研究进行验证。
综上所述, 三维重建虚拟手术规划技术在零缺血LPN治疗cT1b期肾肿瘤中, 可以提供更精确直观的肿瘤及周围脉管系统的解剖关系, 从而为术中精准定位肿瘤及供应血管提供帮助, 更好地控制术中出血、缩短手术时间, 是一种可选择、可推广的方法。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|