起源于卵巢静脉的平滑肌肉瘤极罕见,预后差,多层螺旋CT和三维血管造影有助于诊断。手术切除是目前有效的治疗方法,传统放疗和化疗的疗效仍存在争议。本文报道了我院1例起源于左卵巢静脉的平滑肌肉瘤患者的临床资料及治疗过程,并结合文献复习和讨论了腹膜后平滑肌肉瘤的临床、病理特点、诊断和治疗。
Leiomyosarcoma originating from the ovarian veins is extremely rare, has a poor prognosis, and multislice CT and 3D angiography are helpful in diagnosis.Surgical resection is currently an effective treatment, and the efficacy of conventional radiotherapy and chemotherapy remains controversial.This article describes the clinical data and course of treatment of a patient with leiomyosarcoma originating from the left ovarian vein at our institution, reviewing the literature and discussing the clinical, pathologic features, diagnosis, and treatment of retroperitoneal leiomyosarcoma.
平滑肌肉瘤(leiomyosarcoma, LMS)是一种罕见的平滑肌恶性肿瘤, 发生在消化道、腹膜后、泌尿生殖道或软组织。腹膜后平滑肌肉瘤通常起源于下腔静脉, 或其支流和小血管。它们通常呈块状, 偶有单侧或双侧下肢肿胀, 并且在诊断时通常较大[1]。少数卵巢静脉平滑肌肉瘤在以前的研究中已有报道。我们收治了1例起源于左侧卵巢静脉的平滑肌肉瘤, 现报告如下, 我们将描述此肿瘤的临床表现及手术情况, 并复习相关文献。
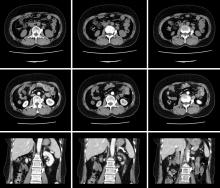
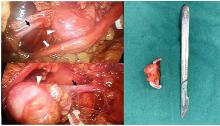
患者, 女, 54岁, 左腹部疼痛2月余于2019年9月16日入院, 无恶心、呕吐等不适, 既往体健, 无高血压、心脏病、糖尿病等病史, 无不良嗜好。查体:双肾区无压痛, 左侧肾区压痛+, 叩击痛, 双侧输尿管走行区无压痛, 膀胱区无隆起及压痛。实验室检查未见明显异常。我院CT示:左肾下极与腹主动脉间富血供、持续强化软组织结节, 性质待定---副神经节瘤?巨淋巴结增生症?其它神经、血管来源病变?(图1)入院后完善术前检查, 无手术禁忌。于2019年9月18日全麻下行后腹腔镜下左腹膜后肿瘤切除术, 手术按张旭教授论著中总结的方法建立腹膜后空间和置入套管[2], 常规清理腹膜后脂肪, 腔镜下观察腹膜后解剖标志, 纵行切开肾周筋膜, 打开脂肪囊, 于平左肾下极寻及输尿管, 发现肿瘤位于输尿管下方, 将肾下极瘤体周围脂肪清理干净, 瘤体与输尿管分离后, 沿瘤体表面继续分离, 发现卵巢静脉穿过瘤体, hemlock夹夹闭瘤体两端静脉, 将瘤体完整切除。观察创面无活动性出血, 置入取物袋, 将肿瘤及清除脂肪放入取物袋内, 取出体外。分层缝合切口, 常规放置引流管, 手术历时约2小时, 出血约5ml, 未输血, 标本送病理。(图2)
术后病理:显微镜下可见嗜酸性梭形细胞呈束状增生, 高度异型增生, 核分裂象不典型。肿瘤内可见血管壁弹性纤维。免疫组化显示肿瘤平滑肌肌动蛋白阳性, S-100蛋白阴性。基于此诊断为源于卵巢静脉的LMS(大小:4cm×2.5 cm×2cm)。详细免疫组化:瘤细胞呈vimentin(+), CKpan(-), S-100(-), SMA(+), STATA6(-), β -catenin浆(+/-), CD56(+/-), Syn(-), CD117(-), CD34(-), Dog-1(-), CD163(-), HMB45(-), melanA(-), Ki67指数≤8%, 支持上述诊断。(图3)
患者目前随访17个月, 未见肿瘤复发及转移。
腹膜后平滑肌肉瘤以位于下腔静脉最为多见。LMS起源于血管中膜的平滑肌细胞, 生长缓慢, 大部分完全血管外生长(60%)[3]。血管内和血管内外同时生成的模式较少见[4]。大多数病例最初没有症状, 只有在引起腹痛或增大到可以触及时才被发现。
自1977年以来, 英文献中仅报道了19例起源于卵巢静脉的LMS(表1)。这些患者的中位年龄为55岁(28~78岁)。9例患者出现腹痛, 5例患者有明显的腹部肿块, 2例患者由体检发现, 1例患者有泌尿生殖道感染。肿瘤最大径中位数为7.5cm(3~28cm)。可见当患者就诊时, 肿瘤往往已经达到相当大的尺寸。
| 表1 卵巢静脉平滑肌肉瘤文献复习 |
文献中报道的19例患者均接受了手术切除:6例仅切除肿瘤, 13例整块切除(7例包括卵巢静脉, 3例包括肾脏切除, 3例包括子宫及附件切除术, 2例包括输尿管切除, 1例包括下腔静脉壁切除, 1例包含结肠切除)。肿瘤转移5例(26.3%)。最常见的转移部位是肺和肝, 通常通过血行转移。血管源性LMS预后较差, 中位总生存期(OS)为5.5年[5]。Italiano等[5]指出肿瘤大小、浸润深度、分级和血管来源与OS显著相关。血管源性LMS具有较高的血行转移潜能, 其预后较其他脏器LMS差。此外, 由于LMS位于腹膜后起病隐匿, 发现时往往已进展到较晚分期, 也是其预后差的一个原因。一些报道指出多层螺旋CT和三维血管造影有助于LMS的诊断[6, 7]。
目前还没有确切的报道证明化疗和放疗对LMS有效, 因此手术切除还是首选治疗方法。一些报道指出, 围手术期放化疗并不能降低血管源性LMS的局部复发率[8]。Hensley等[9]进行了一项针对子宫LMS切除术后辅助化疗(吉西他滨加多西他赛后, 再用阿霉素)的前瞻性研究, 但未发现化疗有确切疗效。但Aiba等[10]认为放疗、化疗及热学疗法是抢救复发性和残留性软组织肉瘤的有效方法。如果肿瘤浸润到其他器官, 推荐扩大切除。Roberts等[11]指出其他治疗像靶向治疗(血小板衍生生长因子抑制剂:奥拉图单抗和酪氨酸激酶抑制剂:帕唑帕尼)和免疫治疗(抗PD-1抗体:纳武利尤单抗, 派姆单抗), 有潜在的治疗意义。
截止目前, 文献中报道的卵巢静脉LMS病例很少, 有很多需要进一步解决的问题, 特别是辅助治疗的方法与时机的选择等等。所以像本病例这样的报道对于更好地了解这些罕见肿瘤的特征有着一定的意义。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|