目的:分析前白蛋白、血红蛋白、纤维蛋白原等临床观察指标与RARC患者的病理特征及预后的相关性。方法:回顾性分析了四川省人民医院2017年01月至2019年12月接受机器人辅助膀胱癌根治术(Robotic-assisted radical cystectomy for bladder cancer, RARC)的148例患者的病理特征、临床观察指标与预后的关系。首先通过受试者工作特征曲线(Receiver Operating Characteristic, ROC)对前白蛋白、血红蛋白、纤维蛋白原等进行分组;然后对于计数资料的组间比较采用χ2检验或Fisher确切概率法;接着采用Kaplan-Meier法计算术后总生存率(overall survival rate, OS)和无进展生存率(Progression-free survival, PFS),并绘制生存曲线,再使用log-rank检验比较不同组间OS和PFS的差异;最后采用Cox回归模型分析影响OS和PFS的危险因素,并获得风险比(Hazard Ratio, HR),本研究中均以 P<0.05表示差异具有统计学意义。结果:前白蛋白、血红蛋白、纤维蛋白原的最佳截断值分别为188.5mg/L、127.5g/L、3.13g/L,由此分为高前白蛋白组115例和低前白蛋白组33例,高血红蛋白组81例和低血红蛋白组67例,高纤维蛋白原组72例和低纤维蛋白原组76例。χ2检验或Fisher确切概率法结果显示:低前白蛋白组与高前白蛋白组相比,前组患者中出现合并有其他病理类型、高病理T分期的比例较高( P<0.05);低血红蛋白组与高血红蛋白组相比,前组患者中出现女性、高病理T分期的比例较高( P<0.05);高纤维蛋白原组与低纤维蛋白原组相比,前组患者中出现合并有其他病理类型的比例较高( P<0.05)。Kaplan-Meier法和log-rank检验结果显示:低前白蛋白组、低血红蛋白组、高纤维蛋白原组的OS和PFS较差( P<0.05)。Cox单因素分析显示:病理分类、病理分级、病理T分期、淋巴结转移、前白蛋白、血红蛋白、纤维蛋白原是预后的危险因素( P<0.05);Cox多因素分析显示:病理分类、病理T分期、前白蛋白、血红蛋白、纤维蛋白原是预后的独立危险因素( P<0.05)。结论:前白蛋白、血红蛋白、纤维蛋白原是RARC患者预后的独立危险因素,可作为术前评估指标。
Objective: To analyze the correlation between clinical indexes (serum prealbumin, hemoglobin, fibrinogen) and the pathological characteristics and prognosis of patients with bladder cancer receiving robot-assisted radical cystectomy (RARC).Methods: A retrospective analysis was performed on the pathological characteristics, clinical indicators, and prognosis of 148 bladder cancer patients who received RARC in Sichuan Provincial People's Hospital from January 2017 to December 2019. According to prealbumin, hemoglobin, fibrinogen, groups were set up by receiver operating characteristic curve (ROC).The χ2 test or Fisher's exact probability method were used for the comparison of count data between groups. The Kaplan-Meier method was used to calculate the postoperative overall survival rate (OS) and progression-free survival rate (PFS), and the survival curve was drawn. The log-rank test was used to compare the differences in OS and PFS between different groups.The Cox regression model was used to analyze the risk factors influencing OS and PFS, and the hazard ratio (HR) was obtained. P<0.05 indicated that the difference was statistically significant.Results: The best cut-off values of prealbumin, hemoglobin, and fibrinogen were 188.5mg/L, 127.5g/L and 3.13g/L respectively, which could be divided into high prealbumin group (115 cases) and low prealbumin group (33 cases), high hemoglobin group (81 cases) and low hemoglobin group (67 cases), high fibrinogen group (72 cases) and low fibrinogen group (76 cases). The results of χ2 test or Fisher exact probability method showed the percentage of patients with other pathological types and high pathological T stagingin the low prealbumin group was higher than in the high prealbumin group ( P<0.05). The percentage of females and high pathological T staging in the low hemoglobin group was higher than in the high hemoglobin group ( P<0.05). The percentage of patients with other pathological types in the high-fibrinogen group was higher than in the low-fibrinogen group ( P<0.05). Kaplan-Meier method and log-rank test results showedthe OS and PFS in the low prealbumin group, low hemoglobin group, and high fibrinogen group were poor ( P<0.05).Cox single factor analysis shows that pathological classification, pathological grade, pathological T staging, lymph node metastasis, prealbumin, hemoglobin, and fibrinogen were risk factors for prognosis ( P<0.05). Cox multivariate analysis showed that pathological classification, pathological T staging, prealbumin, hemoglobin, and fibrinogen were independent risk factors for prognosis ( P<0.05).Conclusion: Prealbumin, hemoglobin, and fibrinogen are independent risk factors for the prognosis of RARC patients, and can be used as preoperative evaluation indicators.
膀胱癌是常见的泌尿系统肿瘤, 其发病率在所有恶性肿瘤中居于第11位, 其中在我国总人群中的发病率为6.69/10万[1]。在2013年对全国肿瘤患者进行调查时发现, 膀胱癌在男性中的发病率(8.40/10 万)远高于女性(2.38/10 万)[2]。由于膀胱癌具有多种不同的病理分类和分级, 以及病理学亚型[3], 预后也不尽相同[4], 因此其诊断与治疗较为复杂。
虽然目前有多种膀胱癌肿瘤标志物的研究取得进展, 但将其实验室成果转化并进入临床应用还需要一定时间[5, 6]。较好的瘤控效果和远期疗效[7]让RARC如今在医生和患者中逐渐普及, 若能够找到对患者预后做出判断的生物标记物, 对于评估患者病情、选择综合治疗方案、降低围手术期风险及制定术后随访方案[8]将具有重要价值。自引进四川省首台“ 达芬奇机器人手术系统” 以来, 本中心已成熟开展RARC, 本研究将回顾性分析2017年01月至2019年12月在四川省人民医院行RARC患者术前的前白蛋白、血红蛋白、纤维蛋白原与其病理特征以及生存情况的相关性, 欲寻找更多评估指标, 为建立全面的术前评估模型提供依据。
纳入2017年1月至2019年12月在四川省人民医院接受RARC的患者, 共148例, 纳入标准:(1)符合膀胱癌根治术手术指征的膀胱癌患者; (2)患者一般状况良好, 无手术禁忌证; (3)术式选择为RARC; (4)术后标本的病理诊断为膀胱癌; (5)可获取完整资料。排除标准:(1)具有绝对手术禁忌症。(2)术前接受过化疗、放疗。(3)同时合并有其他恶性肿瘤。(4)资料不能完整收集, 或无法顺利完成术后随访项目调查者。
病理特征:年龄、性别、病理T分期、病理分类、病理分级、淋巴结转移情况。临床观察指标:前白蛋白、血红蛋白、纤维蛋白原。生存预后指标:OS和PFS。
通过四川省人民医院病案科、信息科检索(检索关键词:机器人、腹腔镜、膀胱癌根治术)于2017年01月至2019年12月行RARC的膀胱癌患者。使用病案系统查询患者的病理特征、术前临床观察指标。再通过门诊、电话两种随访方式收集患者的生存预后情况。最后将以上所有数据录入数据库, 进行统计学分析。
数据分析采用SPSS21.0统计学软件进行分析处理, 首先以RARC患者的术后总生存状态作为观察终点, 绘制上述临床观察指标的ROC曲线, 分别获取最佳截断值, 并依此分组。计数资料采用频数(百分比)表示, 不同组间比较使用χ2检验或Fisher确切概率法, 分析术前临床观察指标与病理特征的关系。再使用Kaplan-Meier法计算OS和PFS, 绘制生存曲线, 并使用log-rank检验分析病理特征、术前临床观察指标与OS和PFS的相关性。最后使用Cox风险回归模型分析OS和PFS的危险因素, 并获得HR。以P< 0.05表示差异具有统计学意义。
按纳入及排除标准整理数据后, 共纳入RARC患者148例。患者的病理特征分组:本研究中患者手术时的中位年龄为65(55, 73)岁, 按中位年龄将RARC患者分为高龄75例(≥65岁), 低龄73例(< 65岁)。按性别分为男性127例, 女性21例。按病理分类分为尿路上皮癌129例, 合并具有多种病理类型或存在组织学变异19例, 其中包含鳞状细胞癌9例, 腺癌5例, 肉瘤样癌4例, 印戒细胞癌1例。按病理分化程度分为高级别或低分化121例, 低级别或高分化27例。按病理T分期分为Ta、T1共48例, 其中包含Ta期8例, T1期40例, T2~T4期共100例, 其中包含T2期82例, T3期9例, T4期9例。按术后所清扫的淋巴结状态分为淋巴结阳性16例, 淋巴结阴性132例。随访时间的终止节点为2021年1月, 中位随访时间为22(14, 35)个月, 其中术后1年、2年、3年的OS分别为79.7%、69.9%、63.5%, 术后1年、2年、3年的PFS分别为77%、66.4%、58.2%。
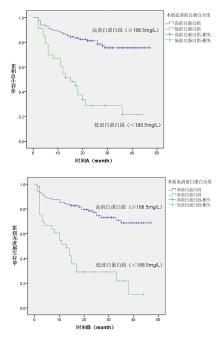
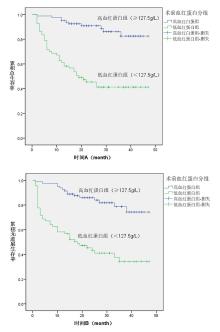
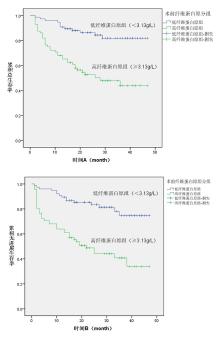
绘制前白蛋白、血红蛋白、纤维蛋白原的ROC曲线(见图1A、图1B、图1C), 曲线下面积(Area Under Curve, AUC)分别为0.748(95% CI:0.664~0.832)、0.812(95% CI:0.742~0.883)、0.735(95% CI:0.647~0.823)。约登指数为0.379时获得前白蛋白的最佳截断值为188.5 mg/L, 约登指数为0.502时获得血红蛋白的最佳截断值为127.5 g/L, 约登指数为0.39时获得纤维蛋白原的最佳截断值为3.13 g/L。依此将患者分为高前白蛋白组(≥188.5 mg/L)共115例和低前白蛋白组(< 188.5 mg/L)共33例, 高血红蛋白(≥127.5 g/L)组81例和低血红蛋白(< 127.5 g/L)组67例, 高纤维蛋白原(≥3.13 g/L)组72例和低纤维蛋白原(< 3.13 g/L)组76例。
χ2检验或Fisher确切概率法显示:低前白蛋白组中具有更多合并有其他病理类型、高病理T分期的患者(P< 0.05), 见表1。低血红蛋白组中具有更多女性、高病理T分期的患者(P< 0.05), 见表2。高纤维蛋白原中具有更多合并有其他病理类型的患者(P< 0.05), 见表3。
| 表1 不同术前血清前白蛋白水平患者的特征比较 |
| 表2 不同术前血红蛋白水平患者的特征比较 |
| 表3 不同术前纤维蛋白原水平患者的病理特征比较 |
Kaplan-Meier法显示:高前白蛋白组3年OS为75.5%, 低前白蛋白组3年OS为21.6%; 高前白蛋白组3年PFS为68.7%, 低前白蛋白组3年PFS为21.8%, 见图4、图5。高血红蛋白组3年OS为82.5%, 低血红蛋白组3年OS为41.3%; 高血红蛋白组3年PFS为78.7%, 低血红蛋白组3年PFS为37.7%, 见图6、图7。低纤维蛋白原组3年OS为81.9%, 高纤维蛋白原组3年OS为43.9%; 低纤维蛋白原组3年PFS为74.7%, 低纤维蛋白原组3年PFS为40.7%, 见图8、图9。
log-rank检验显示:低前白蛋白组患者的OS(P< 0.001)和PFS(P< 0.001)均较高前白蛋白组差, 具有统计学差异。低血红蛋白组患者的OS(P< 0.001)和PFS(P< 0.001)均较高血红蛋白组差, 具有统计学差异。高纤维蛋白原患者的OS(P< 0.001)和PFS(P< 0.001)均较低纤维蛋白原组差, 具有统计学差异。
将本研究中所有病理特征及术前临床观察指标纳入Cox单因素分析中, 结果显示RARC患者中合并其他病理类型、高级别、T2~T4期、淋巴结转移阳性以及低前白蛋白、低血红蛋白、高纤维蛋白原是RARC患者OS和PFS的危险因素, 差异具有统计学意义(P< 0.05), 详见表4。
| 表4 单因素Cox回归模型分析 |
为了解Cox单因素分析所筛选出的具有潜在预后价值的病理特征及术前临床观察指标是否为RARC患者的独立预后因素, 将病理类型、病理分级、病理T分期、淋巴结转移、前白蛋白、血红蛋白、纤维蛋白原纳入Cox多因素分析以排除混杂变量。结果显示:高病理T分期、病理分类、低前白蛋白、低血红蛋白、高纤维蛋白原为RARC患者术后OS、PFS的独立危险因素(P< 0.05), 见表5。
| 表5 多因素Cox回归模型分析 |
随着微创技术的进步和围术期早期康复方案的引入, 膀胱癌患者的预后得以逐渐改善[9], 其中以机器人辅助腹腔镜手术为当前微创外科领域的代表, 其在视野清晰度、三维视觉、操作精细度及灵活度方面均较传统普通腹腔镜存在明显优势, 而且可以在手术过程中避免术者的生理性震颤并缓解主刀医师的体力消耗等。RARC对于提高膀胱癌的整体治疗效果呈现出较大的微创优势, 在未来必然会是膀胱癌治疗方式的重要支撑。 RARC的相关研究不断更新, 无论是从技术层面, 还是从整体疗效, 逐步规范RARC手术流程、完善治疗体系, 对于延长膀胱癌患者的生存期具有重要意义。
营养状态不佳在恶性肿瘤病人中十分常见[10], 由于血清前白蛋白的半衰期远小于血清白蛋白, 并且可在医院实验室中轻松测量, 成本低, 临床上常把它作为反映患者近期营养不良的常用指标[11, 12]。血清前白蛋白在机体的炎症、免疫、营养[13]等方面有重要作用, 其中对于恶性肿瘤的反应也较为敏感[14]。现如今术前血清前白蛋白已被应用于肺癌[15]、胃癌[16]、肝癌[17]等多种恶性肿瘤的预后评估, 但也有研究发现其对于乳腺癌患者的预后评估效能较差[18], 而此指标目前较少应用于泌尿系肿瘤。在我们的研究中发现:低前白蛋白组比高前白蛋白组具有更多的合并有其他病理类型与高病理T分期的患者, 而两组患者的预后也表现出较为明显的差异, 并且前白蛋白是预后的独立危险因素。汤仕杰[19]等人的研究也有类似发现, 术前低水平血清前白蛋白的膀胱尿路上皮癌患者与术前高水平的患者相比, 前者具有更大的年龄、更晚的肿瘤分期分级、更高的远处转移发生率和术中输血率, 而且血清前白蛋白是膀胱癌根治术患者预后的独立危险因素。血清前白蛋白水平的降低可能与恶性肿瘤患者营养摄入状况差、肿瘤生长消耗所致的负氮平衡密切有关, 营养状态的改变又与器官功能降低和免疫状态恶化具有紧密的相关性, 并有可能导致外科手术死亡率的增加[20, 21], 对于膀胱癌根治术这类重大手术而言, 手术可能会改变机体的代谢分解状态, 进而增加机体对营养的需求, 可能使患者术后面临营养不良的风险进一步增加, 营养不良又会反作用于机体导致术后恢复减慢, 使医院获得性感染等并发症的发生风险增加。
低血红蛋白血症的恶性肿瘤患者常常伴随慢性低氧血症, 它代表着氧气供应和消耗之间的失衡, 而低氧可通过刺激局部血管生成、增加肿瘤细胞对凋亡的抵抗以及获得基因突变等多个方面来增强肿瘤的生长, 如VEGF基因上调[22], 潜在地增加肿瘤细胞的生物侵袭性, 导致肿瘤细胞在早期扩散的可能性更高; 低氧还可能促使机体在接受化疗、放疗后产生更多的自由基, 其所带来的杀伤力将会抵抗放化疗对肿瘤的治疗作用[23]。另一方面, 由恶性肿瘤所产生的癌症相关性炎症可能释放各种炎症因子, 从而影响促红细胞生成素的合成, 导致血红蛋白下降[24]。我们的研究中发现:术前低血红蛋白组的患者中, 女性和高病理T分期所占比例较大。两组患者预后差异明显, 且低血红蛋白是预后的独立危险因素。Zhang[25]等人的研究与我们的结果相似, 按术前血红蛋白为125g/L作为临界值时, 性别、病理T分期、淋巴结转移状态在两组之间具有差异, 并且在行膀胱癌根治术后可以观察到, 低血红蛋白组患者的生存情况明显差于高血红蛋白组。
越来越多的证据表明纤维蛋白原与肿瘤生物学之间存在相互作用的关系[26], 已发现纤维蛋白原对多种不同肿瘤的进展和转移具有影响[27, 28]。纤维蛋白原促进恶性肿瘤生长和侵袭可能存在以下几种机制[29, 30], 第一方面, 纤维蛋白原可促进肿瘤血管的生成; 另一方面, 纤维蛋白原可诱导特定的细胞释放白介素-8、肿瘤坏死因子等细胞因子或趋化因子, 可为肿瘤细胞的迁移提供结构支持, 有利于恶性肿瘤的生长和迁移, 此外, 还发现纤维蛋白原可通过抑制NK细胞等免疫细胞对肿瘤的清除作用, 从而增加了肿瘤细胞转移的潜力, 进而促进了肿瘤的进展。纤维蛋白原在机体的凝血过程可形成纤维蛋白凝块, 其可能参与了膀胱癌患者血尿发生后受损血管的修复, 也对产生活跃的肿瘤相关性血管起促进作用[31], 因此膀胱癌患者体内的纤维蛋白原升高可能是预后不良的标志物, 同时是患者机体内高凝状态的反映, 这预示着术后发生静脉血栓栓塞的风险增加。在我们的研究中发现:合并有其他病理类型的膀胱癌患者体内更容易出现较高水平的纤维蛋白原。低纤维蛋白原组与高纤维蛋白原组的预后差异较大, 而且纤维蛋白原为预后的独立危险因素。朱阿丽[32]等人的研究中发现, 高纤维蛋白原是RARC患者术后早期死亡的危险因素, 此研究中的临界值为3.29 g/L。
综上所述, RARC患者的低前白蛋白、低血红蛋白、高纤维蛋白原与术后生存及进展密切相关, 并且是预后的独立危险因素, 可作为临床评估预后的有效检验指标。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|