目的:观察神经电生理监测系统在机器人辅助腹腔镜根治性前列腺切除术中进行盆底神经解剖性定位、全程功能监测和功能保护的应用情况,探讨术中保护盆腔神经及神经监测的应用前景。方法:选取2021年1月–2021年4月在中国人民解放军总医院第一医学中心确诊为前列腺癌,并接受根治性前列腺切除术的患者11例,患者术前勃起、尿控及排便功能均正常。术中进行盆底神经电生理监测:先进行盆底神经解剖性分离定位(上腹下丛、腹下神经、盆丛及其各分支),予以电刺激后记录监测时间点效应器官(阴茎海绵体肌、尿道内外括约肌、肛门括约肌)的全程神经电生理波形图,同时记录手术时间、术中失血量、术后尿管拔除时间、即刻及远期尿控情况、术后恢复排气时间、术后恢复排便时间、术后勃起功能评分、尿控及肛门失禁评分等指标。结果:11例手术均顺利完成。术中保留神经方式:5例使用双侧筋膜外技术,4例使用双侧筋膜内技术,1例使用左侧筋膜间,右侧筋膜外技术,1例使用左侧筋膜内,右侧筋膜间技术。患者年龄(61.90±4.70)岁,BMI (26.09±3.91)kg/m²,手术时间(193.20±42.97)min,平均术中出血量(109.10±43.69)mL,术后拔除尿管时间(14.82±1.78)d。4例双侧筋膜内患者术后即刻尿控良好,尿失禁评分(ICIQ-SF评分)≤4分,其中3例术后6个月复查IIEF-5与勃起硬度评分明显下降,剩余1例在术中切除前列腺前后予以电刺激诱发,均出现阳性肌电图波形且振幅无明显变化。该患者术后勃起,尿控及排便功能恢复良好。结论:在根治性前列腺切除术中行盆底神经解剖性定位,并应用神经电生理监测安全可行;术中实时监测到的肌电图波形与患者术后功能恢复情况具有一定相关性,为预测患者术后功能保留及恢复提供了一种具有临床应用前景的方法。
Objective: To explore the clinical significance of anatomical localization and real-time neuro-electrophysiological monitoring of pelvic organ nerves to preservation of pelvic organ nerves in robot-assisted laparoscopic radical prostatectomy (RALP).Methods: A total of 11 patients with prostate cancer who were treated at the PLA General Hospital from January 2021 to July 2021 with normal erectile function,urinary function,anorectal function before operation were selected to undergo neuro-electrophysiological monitoring of pelvic organ nerves during RALP. During the operation, the pelvic organ nerves (superior hypogastric plexus, hypogastric nerve, pelvic plexus and their branches) were dissected and stimulated. After electrical stimulation, the changes of the electrophysiological waveforms of the effector organs (the Corpus cavernosum, urethral sphincter and ani sphincter) were recorded. Meanwhile, the operation duration, blood lost during operation, the time of the uric catheter removal, the situation of immediate and long-term continence, the time of recovery of ventilation and defecation, the scores of postoperative erectile function, urinary function, anorectal function after the operation were recorded.Results: All 11 patients underwent surgery successfully. For nerves preservation, 5 patients underwent bilateral extrafascial technique, 1 patient was given left interfascial right extrafascial technique, and 4 patients were subjected to bilateral intrafascial technique, 1 case received left intrafascial and right interfascial technique. The average age was (61.90 ± 4.70) years, the average body mass index (BMI) was (26.09 ± 3.91) kg/m², the average operation duration was (193.20 ± 42.97) min, the average intraoperative blood loss was (109.10 ± 43.69) mL, and the postoperative time of uric catheter removal was (14.82 ± 1.78) days. Four patients with bilateral intrafascial surgery recovered immediate continence well and their incontinence score (ICIQ-SF score) ≤4. The IIEF-5 and EHS scores in 3 of these patients decreased significantly 6 months after surgery, and the rest one had good recovery of erectile, urinary continence and anorectal function whose electrophysiological waveforms had significant change after stimulation during operation.Conclusions: Anatomical localization and real-time neuro-electrophysiological monitoring of pelvic organ nerves during RALP is safe and feasible with the nerve electric monitoring system. The electromyography waveform of real-time nerve monitoring during operation is correlated with the recovery of erectile function, urinary function, anorectal function, which provides a promising method for predicting the preservation and recovery of these functions after operation.
根治性前列腺切除术是治疗局限性前列腺癌最常用的术式。由于前列腺周围神经血管束(neurovascular bundles, NVBs)由盆丛发出, 呈网状分布于前列腺周围[1], 术中极易损伤, 从而引起患者术后勃起、尿控及排便功能障碍[2]。目前常采用筋膜间或筋膜内技术在术中保留NVBs, 但无法通过术前或术中显像技术定位神经, 缺少成熟的术中神经实时功能监测方法, 只能依靠术者的经验进行神经的保留[3]。本研究验证了机器人辅助腹腔镜根治性前列腺切除术中实施盆底神经解剖性定位及盆底神经电生理监测技术的安全性及可行性, 为术中识别神经并验证神经功能的完整性提供一种有前景的方法。
选取2021年1月– 2021年4月中国人民解放军总医院第一医学中心确诊为前列腺癌, 并接受根治性前列腺切除术的患者11例, 患者术前勃起、尿控及排便功能均基本正常, 具有保留神经需求。纳入标准:①病理确诊前列腺癌(临床分期≤ T2cN0M0), 需行根治性前列腺切除术, 且国际勃起功能问卷-5(international index of erectile function5, IIEF-5)≥ 18分。②患者理解手术及研究过程并自愿签署知情同意书。排除标准:①合并严重心肺功能异常, 或凝血功能障碍, 无法接受手术治疗。②术前有勃起功能障碍, 尿控及排尿功能障碍者。③安装心脏起搏器或接受其他电生理治疗者。④既往有腹盆腔手术史或放疗史, 曾接受前列腺电切术者。⑤有中枢及外周神经病变的患者。⑥有严重焦虑、抑郁、躁狂或精神类疾病, 无法配合治疗及随访者。⑦合并其他恶性肿瘤病史者。⑧严重过敏体质者。⑨由于其他原因医师不建议接受神经监测方案的患者。退出标准:①在纳入后发现不符合试验方案者。②纳入后发现患有严重躯体或精神疾病者。③拒绝接受手术治疗, 要求药物或其他治疗方式者。④术后需接受内分泌治疗或盆腔放疗患者。
评估指标:术前评估患者年龄、身高、体质量指数(body mass index, BMI)、婚育、吸烟、饮酒等一般情况, 高血压、糖尿病、冠心病等基础病史及患者术前血清PSA(总/游离)、穿刺病理结果、Gleason评分、PI-RADS评分、临床分期评分等。
通过问卷评估勃起功能、尿控功能、排便功能、抑郁情况:①勃起功能采用IIEF-5与勃起硬度分级(erection hardness score, EHS)进行评估。IIEF-5问卷由5个问题组成, 每个问题0~5分, 得分越低, 勃起功能障碍越严重[4]。EHS分为Ⅰ ~Ⅳ 级, 级别越低, 勃起功能障碍越严重[5]。②尿控功能评估根据尿失禁问卷简表(international consultation on incontinence questionnaire-short form, ICIQ-SF)进行评估, ICIQ-SF问卷由3个问题组成, 总分越高, 控尿功能障碍越重[6]。③排便功能评估采用Wexner失禁评分, 总分0~20分。得分越高, 排便功能障碍越严重。④患者心理评估采用抑郁自评量表(self-rating depression scale, SDS)进行评估, SDS由20个问题组成, 每个问题得分0~4分, 总粗分乘以1.5即为标准分。以SDS标准分≥ 50分为有抑郁症状[7]。
全部患者均由经验丰富的泌尿外科医师行机器人辅助腹腔镜根治性前列腺切除术。依据NCCN 2020前列腺癌指南, 按临床分期, Gleason评分及PSA水平将患者分为低危、中危及高危。低危患者临床分期T1~T2a或Gleason评分2~6分或PSA< 10 μ g/L, 高危患者临床分期≥ T3a, Gleason评分≥ 8分或PSA≥ 20 μ g/L, 中危患者介于二者之间。依据患者前列腺癌危险度选择不同的神经保留技术:低危患者行双侧筋膜内术式, 高危患者行双侧筋膜外术式, 中危患者根据术中所见决定具体手术方式。患者入室后, 将体表监测电极置于患者阴茎海绵体皮肤表面, 针状监测电极置入肛门括约肌。当手术解剖至尿道括约肌处, 将腔镜下监测电极分别置入尿道内外括约肌。将各监测电极与计算机连接, 手术全程实时监测操作中各效应器肌电图变化(图1)。
患者术前均留置胃管及导尿管, 术后常规应用抗生素预防感染。记录手术时间、术中失血量、术后尿管拔除时间、术后恢复排气排便、饮食时间等。于术后2周、1、3、6个月进行随访, 除常规术后随访外, 再次评估患者勃起功能、尿控功能、排便功能。
采用SPSS 26.0统计软件处理数据。计量资料若符合正态分布, 则用$\bar{x}\pm s$表示, 不符合正态分布以中位数(M)和四分位数间距(Q1, Q3)表示。计数资料用例数表示。
纳入患者年龄(61.90± 4.70)岁, BMI(26.09± 3.91)kg/m² , 术前总PSA为12.54(9.86, 20.75)μ g/L, ASA分级为1级者2例, 2级者8例, 3级者1例; Gleason分级为3+3者2例, 3+4者4例, 4+3者3例, 4+5者2例; 术前勃起功能评估IIEF-5≥ 18者11例; EHS分级为Ⅱ 、Ⅲ 、Ⅳ 级者分别为2、6、3例; ICIQ-SF评分≤ 4分者11例; Wexner便秘评分≤ 3分者11例。
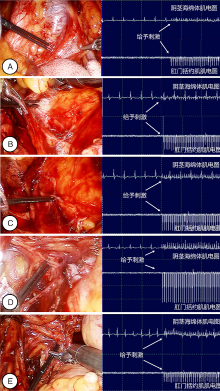
11例患者术中对神经予以电刺激后均可监测到各效应器肌电图出现阳性波形(图2)。
11例患者均未发生严重围手术期并发症。4例采用双侧筋膜内技术的患者术后即刻尿控均良好, ICIQ-SF≤ 4分, 而其中3例术后6个月复查IIEF-5≤ 6分, EHS均由术前的Ⅲ 级降至Ⅰ 级。剩余1例患者术后6个月IIEF-5为22分, EHS与术前一致, 仍为Ⅲ 级。
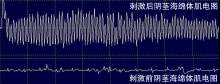
选取2例典型患者, 记录患者的围术期资料及术中监测图形(图2、3)。2例患者分别接受筋膜外和筋膜内技术, 采用筋膜外技术者(患者1)于切除前列腺前刺激上腹下丛及盆丛各分支, 可见阴茎海绵体与肛门括约肌肌电图出现刺激波形; 于切除前列腺后刺激盆丛前列腺支神经, 可见阴茎海绵体与肛门括约肌出现刺激波形, 幅度较切除前列腺前减小。术后随访显示该患者术后勃起、尿控及排便功能均不同程度受损, 同时其SDS抑郁评分较术前上升。采用筋膜内技术者(患者2)于切除前列腺前刺激盆丛前列腺支, 可见阴茎海绵体出现明显波形改变(图3)。同时可见患者阴茎增粗。在前列腺切除后再次予以刺激, 其肌电图仍出现同样振幅的明显改变。术后随访显示该患者各项功能得到较好的保留。
盆丛, 即下腹下丛, 由上腹下丛延续到直肠两侧, 伴随髂内动脉的分支组成直肠丛、精索丛、输尿管丛、膀胱丛、前列腺丛、子宫阴道丛等, 并随动脉分支分布于盆腔各脏器。NVBs是盆丛的一部分, 多数NVBs随血管到达脏器内, 如随前列腺周围血管进入前列腺, 支配的器官有前列腺、精囊腺、尿道外括约肌、阴茎海绵体等, 其中阴茎海绵体神经为其远端最主要部分。在远端, NVBs的副交感神经主要走行于后外侧控制勃起功能, 而前侧的神经束主要支配肛提肌以及前列腺[8]。
根治性前列腺切除术在切除前列腺的过程中易损伤NVBs, 引起勃起功能、尿控功能及排便功能障碍。因此, 以往观点认为, 采用筋膜内或筋膜间保留NVBs的术式即可最大限度保留勃起功能, 本文依据术中神经功能监测结果发现, 在根治性前列腺切除术中仅解剖上保留NVBs并不能保证神经传导的完整性, 同时由于术中热损伤、牵拉、Hem-o-lok夹相关损伤等因素, 可影响神经功能, 术后随访结果显示, 3例采用保留NVBs术式的患者仍出现上述功能障碍。
由于包绕前列腺的NVBs较细小, 难以在术中游离, 实现直视下的神经的保护。但根据其解剖关系, 游离上游更粗大的上腹下丛神经、腹下神经并由上至下进行逐步分离是可行的。利用腔镜下刺激与监测系统, 可配合手术进程, 完成神经实时电生理监测。
与既往报道相比, 本文中的患者除因实施术中神经监测所致手术用时延长外, 其术中出血量、围手术期并发症发生率等指标与常规手术无明显差异[9]。11例患者均未出现术中及术后严重并发症, 证实术中神经监测安全可行。在初期探索后, 我们优化了电极置入流程, 使后5例患者的神经监测准备时间较前6例缩短约30 min。
肌电图变化的具体情况以2例典型患者进行讨论, 发现这2例患者术中神经监测所得波形反应与其术后相应功能保留及恢复呈现出相关性, 并与其所选术式对神经保护与功能保留的预期相符。
本研究为探索性研究, 存在一定的局限性, 如样本量较小, 术中监测到的肌电图波形规律还不具有普遍性与代表性, 其阳性反应的判读标准个体差异性较大。且由于刺激电极的选择, 术中监测时机及感受器的监测结果解读均不成熟, 阴茎海绵体肌电图受影响因素多, 不稳定, 勃起的信号波形阈值目前还存在争议[10, 11, 12, 13, 14]。需在后续研究中纳入更多患者, 归纳具有代表性的肌电图反应波形规律, 力争达到神经监测量化波形的标准化; 并通过完善操作过程, 确定与预后更相关的监测位置及时点, 减少术中监测次数, 更进一步缩减术中监测耗时以提高神经监测的安全性。此外, 本研究观测指标勃起功能、尿控功能、排便功能的评估多采用主观问卷调查的形式, 具有一定偏倚, 后续需要寻找更客观、准确的指标。
综上所述, 在前列腺癌根治性切除术中进行盆底神经解剖性定位及神经实时电生理检测, 具有安全性及可行性, 有望进一步研究其应用以改善患者术后生活质量。同时术中监测肌电图的判读标准有待进一步探索和确立, 患者的各项功能也有待选用更客观的评估指标, 更好地实现术中神经监测的价值。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|