膀胱癌和前列腺癌是泌尿外科常见的恶性肿瘤, 其疾病特点及治疗方式各不相同。接受放射性粒子植入治疗的膀胱癌合并前列腺癌患者临床少见, 对于该类患者的诊治并无明确共识。本中心于2015年6月对1例前列腺癌放射性粒子植入术后膀胱癌复发的患者进行腹腔镜膀胱根治性切除+回肠输出道术, 随访5年6个月, 疗效较好, 汇报如下。
患者, 男, 67岁。2010年11月– 2015年6月4次因“ 膀胱肿瘤” 在北京中医药大学东直门医院泌尿外科住院治疗, 治疗过程如下:
2010年11月患者因“ 发现膀胱肿物1个月” 就诊。超声检查提示膀胱左下前壁局限性占位性病变(1.5 cm× 1.5 cm), 行经尿道膀胱肿瘤电切术(transurethral resection of bladder tumor, TURBT), 病理报告提示移行细胞癌Ⅱ ~Ⅲ 级, 未侵犯肌层。术后规律给予膀胱内吡柔比星灌注化疗, 定期复查超声和膀胱镜。化疗方案:术后即刻膀胱灌注, 从术后1周开始, 每周1次, 共8次, 以后每月1次至1年。患者术后1、3、6个月复查膀胱镜, 如果未见明显异常, 随后每1年复查一次; 超声每半年复查一次。2012年9月患者接受超声检查, 提示左侧后壁及侧壁可见中高回声(大小分别为1.1 cm× 1.0 cm、0.9 cm× 0.8 cm), 考虑膀胱癌复发, 遂行TURBT。病理报告提示移行细胞癌Ⅱ ~Ⅲ 级, 未侵犯肌层。术后规律膀胱内灌注吡柔比星化疗。患者住院期间检查总前列腺特异性抗原(total prostate specific antigen, tPSA):9.68 μ g/L, 游离PSA(free-PSA, fPSA):0.987 5 μ g/L, fPSA与tPSA比值(f/t):0.10; 前列腺MRI示前列腺中央带信号欠均匀, T2WI外周带右后方可见结节状信号减低; 行超声引导下经直肠前列腺穿刺活检, 共12针。穿刺病理提示:2针为前列腺癌, Gleason评分:3+3=6。综合影像和病理结果, 临床分期为T2aN0M0。向患者及家属详细说明病情, 患者不接受根治性切除手术, 选择经会阴前列腺放射性粒子植入术, 术后复查tPSA< 0.002 μ g/L并一直维持此水平, 无明显粒子植入术后相关并发症。
患者于2015年2月超声检查, 提示膀胱左侧壁(0.8 cm× 0.5 cm)中等回声占位, 考虑膀胱肿瘤复发, 再次行TURBT, 术后病理提示, 尿路上皮癌Ⅱ ~Ⅲ 级, 部分固有层可见侵犯。术后规律接受表柔比星膀胱内灌注化疗(化疗方案同首次化疗)。
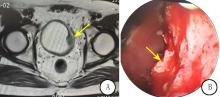
患者于2015年6月接受超声检查提示, 膀胱左侧壁不均质偏强回声(2.0 cm× 1.1 cm); MRI提示膀胱占位性病变(图1A), 考虑膀胱癌复发并向肌层浸润可能, 行膀胱镜检+诊断性TURBT, 术中可见膀胱内左侧顶后壁坏死物质附着, 膀胱左侧壁距膀胱颈约2 cm可见隆起肿物, 大小约2 cm× 3 cm, 基底宽(图1B)。术后病理结果提示浸润性尿路上皮癌。患者接受进一步PET-CT检查:膀胱左侧壁增厚伴钙化, 葡萄糖代谢增高, 考虑恶性病变, 其他部位放射性分布未见异常。结合患者影像学和病理结果, 诊断为膀胱癌, 临床分期T2N0M0, 有根治性膀胱切除手术指征, 于2015年6月24日行腹腔镜下根治性膀胱切除+回肠输出道术。切除标本如图所示(图2A、B)。
患者取平卧位, 头低脚高, 建立人工气腹, 采取5点穿刺法。于髂总动脉分叉处表面剪开腹膜, 充分游离输尿管。于膀胱直肠陷窝最低点上方3 cm左右横行切开腹膜, 打开狄氏筋膜, 在钝性分离直肠与前列腺间隙时, 发现粘连严重, 无法充分分离。沿两侧脐内侧韧带外侧打开腹膜, 分离膀胱侧韧带, 使用Hem-o-lok夹闭后离断。游离膀胱前间隙, 显露耻骨前列腺韧带, 用超声刀打开两侧盆筋膜返折和耻骨前列腺韧带, 缝扎阴茎背静脉复合体后使用超声刀切断, 继续分离至前列腺尖部, 剪开尿道前壁, 将尿管拉起, 近端用Hem-o-lok夹闭, 远端剪断, 保持气囊充盈用作牵引及堵塞尿道近端开口。牵引尿管, 逆行分离前列腺直肠间隙, 前列腺侧韧带用Hem-o-lok夹闭后离断, 将膀胱前列腺完全游离。采取回肠输出道作为尿流改道方式。手术时间为8 h35 min, 出血量约为150 mL, 未输血。
患者术后第3天排气, 术后2周拔除输尿管改道支架管, 无直肠损伤、尿漏、肠梗阻等并发症。术后病理提示:膀胱浸润性尿路上皮癌Ⅲ 级, 肿瘤组织浸润至肌层, 伴坏死及灶性钙化, 可疑脉管内癌栓, 肿瘤组织周围尿路上皮增生, 异型增生、癌变, 并见钙化及异物型多核巨细胞反应; 前列腺组织可见慢性炎性改变、钙化, 纤维组织增生, 腺上皮增生, 有不典型性(核大、有核仁), 考虑为治疗后反应, 尿道断端未见癌组织累及。术后随访5年, 一般情况良好, 未见肿瘤复发转移, 无输尿管回肠吻合口狭窄, 腹壁造口引流通畅(图2C)。
膀胱癌与前列腺癌是男性泌尿系统常见的恶性肿瘤, 发病率均呈上升趋势。膀胱与前列腺关系非常密切, 解剖结构上膀胱与前列腺毗邻; 在发病上两种肿瘤相互影响, 可借尿路或其他途径实现相互侵犯或转移。膀胱癌与前列腺癌两者关系主要有两种情况:一种是膀胱癌伴偶发前列腺癌(incidental prostate cancer, IPCa)。IPCa指缺乏典型临床表现, 术前未确诊前列腺癌, 在非前列腺癌手术的标本中, 组织学检查偶然发现的前列腺癌。IPCa属于多发性原发肿瘤(multiple primary carcinoma, MPC), 即存在两种或两种以上不同细胞类型的原发性肿瘤, 肿瘤可在同一器官或不同器官存在, 每种肿瘤都有各自特点, 并且排除多灶癌或转移癌的可能[1]。Dembowski等[2]在116例根治性膀胱全切标本中发现有17例合并前列腺癌(14.6%)。Fahmy等[3]通过荟萃分析显示, 13 140例根治性膀胱全切标本中伴发前列腺癌者3 335例(24.4%), 这可能与浸润性膀胱癌患者的不良特征和预后有关。Yang等[4]分析了340例中国男性膀胱根治性全切标本, 发现有95例(28%)合并前列腺癌, 并显示在过去十年中, 中国膀胱前列腺切除术标本中偶然前列腺癌的发生率有所增加。因此, 膀胱癌合并前列腺癌有着较高的发生率, 对于老年男性膀胱癌患者, 需进行PSA、经直肠指诊以及必要的影像学检查, 如有必要需进行前列腺穿刺活检明确诊断, 根据病理结果确定治疗方案。另一种类型是膀胱癌伴临床型前列腺癌, 依据患者临床表现、血清PSA水平、直肠指诊、经直肠前列腺超声及前列腺穿刺活检等可以发现和确诊[5]。临床上对于膀胱癌和前列腺癌并存的患者诊治方案尚无统一标准, 且缺乏大样本临床研究。对本例患者临床资料分析, 患者第一次膀胱癌住院期间, PSA和前列腺超声均正常, 无前列腺癌表现。在两年后因膀胱癌复发第二次住院期间检查发现PSA升高(tPSA> 9.68 μ g/L)、f/t:0.10、MRI示前列腺中央带信号欠均匀, T2WI外周带右后方可见结节状信号减低; 行超声引导下经直肠前列腺穿刺活检, 有两针病理显示为前列腺癌, Gleason评分:3+3=6, 临床分期为T2aN0M0, 行经会阴前列腺放射性粒子植入术。综合患者临床资料, 当属于膀胱癌伴发前列腺癌, 经放射性粒子植入术效果良好, 术后随访复查PSA一直维持在低水平。
放射治疗(radiation therapy, RT)是局限性前列腺癌的有效方法之一, 本患者前列腺癌行放射性粒子植入治疗。然而, 粒子具有放射性, 可产生相应不良作用, 此患者膀胱癌复发和进展与放射性粒子治疗可能存在一定相关性。有证据表明, 放射性粒子植入治疗可增加继发恶性肿瘤的风险, 膀胱作为前列腺毗邻脏器, 前列腺局部放疗有可能会对膀胱癌发生或复发产生影响[6], 放射性治疗后血尿需仔细检查, 需要警惕膀胱癌的发生。Krasnow等[7]认为前列腺癌放疗时, 年龄是影响恶性肿瘤发生发展的重要因素, 越年轻者继发恶性肿瘤的发病率越高。Nieder等[8]从Surveillance、 Epidemiology和End Results数据库中分析243 082例行根治性前列腺切除或放疗的资料, 结果显示, 与根治性前列腺切除相比, 放疗对膀胱癌发生的风险比率(hazard ratio, HR)分别为:外照射放疗1.88、近距离放疗1.52、外照射+近距离放疗1.85。Yee等[9]收集了144例诊断膀胱癌之前有前列腺癌病史的患者资料发现, 与前列腺根治性切除手术相比, 前列腺癌放疗患者膀胱癌的诊断时间延长, 膀胱肿瘤分期和分级升高, 膀胱癌5年特异性生存率降低。最近的研究结果也与此一致, Zhao等[10]分析15项研究中619 479例患者, 其中206 852例接受放疗, 经过进一步研究得出, 与根治性手术相比, 放疗与膀胱癌发生风险显著相关(总HR:1.6; 内放射HR:1.33)。Moschini等[11]研究认为与前列腺根治性切除相比, 外放射增加膀胱癌风险(HR:1.35)。因此, 无论外放射还是内放射都有促进膀胱癌发生、演进的风险。本例患者2010年11月首次发现膀胱癌, 行TURBT, 病理检查结果为移行细胞癌Ⅱ ~Ⅲ 级, 未侵犯肌层。2012年9月发现膀胱癌复发, 再行TURBT, 病检结果与第一次相同; 同时进行放射性粒子植入治疗前列腺癌。2015年2月膀胱癌复发, TURBT后病检提示为尿路上皮癌Ⅱ ~Ⅲ 级, 部分固有层可见侵犯, 较前有进展。2015年6月肿瘤复发, 行根治性膀胱切除术, 术后病检结果为浸润性尿路上皮癌Ⅲ 级, 癌组织浸润至肌层。患者自粒子植入, 膀胱癌复发后的病理分期和分级均增高, 推测放射性对膀胱癌复发和演进的影响不能排除。
放射线可导致盆腔纤维化, 增加膀胱根治性切除手术难度和围手术期并发症[12, 13]。Bostrom等[14]回顾性分析34例前列腺癌放疗史行开放性膀胱全切患者, 其中1例出现直肠损伤。尽管放疗可以造成膀胱/前列腺与直肠之间的平面分离困难, 但是严重并发症的发生率与未经放射治疗行根治性膀胱切除术的患者没有显著差异, 术者经验、操作熟练是手术成功重要因素。本例患者经前列腺放射粒子植入治疗2年9个月后出现肌层浸润性膀胱癌复发, 放射线及电切引起的液体外渗等因素造成前列腺与周围组织粘连严重, 使得剥离更加困难, 特别是游离前列腺和直肠之间的平面, 术中采用逆行和顺行相结合的方式游离膀胱及前列腺, 未发生肠梗阻、尿瘘、直肠损伤等严重并发症。
本例患者2012年第二次入院时发现, 膀胱有两处肿瘤, 大小分别为1.1 cm× 1.0 cm、0.9 cm× 0.8 cm, 电切后病理:移行细胞癌Ⅱ -Ⅲ 级, 未侵犯肌层; 同时发现前列腺癌, Gleason评分为6分, 患者及家属不愿接受根治性手术。根治性放疗与根治性前列腺切除术均是局限性前列腺癌的治愈性治疗方式[15], 本例患者穿刺病理Gleason评分为6分, 属于低危, 临床分期为T2aN0M0, 放射性粒子植入术后PSA一致处于低水平。2015年膀胱癌复发后行膀胱根治术后标本病理显示, 未发现前列腺癌组织, 表明放射性粒子植入效果良好。与根治性手术相比, 粒子植入治疗后排尿仍通过自然腔道, 排尿可控, 对勃起功能的影响也较小, 治疗效果肯定, 但放疗有二次致癌的风险[6], 术后需要密切随访。当然, 对于膀胱癌合并前列腺癌, 为避免放射线对膀胱癌的影响, 根治性手术是主要治疗方案, 但须与患者充分沟通, 进行综合考虑。
根治性膀胱切除术后需进行尿流改道, 常见解决方案包括回肠输出道、原位新膀胱以及输尿管皮肤造口等术式。与回肠输出道术相比, 原位新膀胱术在生活质量方面显示出一定的优势。年轻、已婚男性且病理分期低, 尤其是T2期患者更适合接受原位新膀胱[16]。原位新膀胱最大限度地保留了正常解剖结构, 但手术耗时长, 难度大, 尤其对于有盆腔手术史的患者, 易导致手术成功率降低及严重并发症, 术后患者须接受充分的教育及长时间的康复训练[17]。Bostrom等[14]报告34例前列腺癌放疗史行开放性膀胱全切患者中33例选择回肠输出道; Sandhu等[18]报道, 28例患者中27例选择回肠输出道, 1例选择回肠新膀胱的患者出现严重的尿失禁; 因此, 他们认为原位新膀胱不适合对于这类患者。输尿管皮肤造口虽操作简单, 术后恢复快, 但因输尿管管径小、管壁薄, 易发输尿管缺血, 导致造口狭窄, 此术式多用于一般状况较差, 预期寿命短的患者。本患者虽然经过前列腺癌离子植入治疗及多次TURBT, 但一般状况良好, 预期寿命较长, 与患者及家属充分沟通后, 选择回肠输出道术作为尿流改道方式。术后随访5年半, 无肿瘤复发、无输尿管回肠吻合口狭窄等远期并发症。
综上所述, 对于局限性前列腺癌的放射治疗, 无论外放射还是内放射都有促进膀胱癌发生和演进的风险, 放射治疗后的患者应密切随访; 若发现肿瘤浸润肌层, 应行膀胱前列腺根治手术。放射线导致盆腔纤维化增加手术的难度, 通过充分准备和精细操作, 腹腔镜根治性膀胱切除术+回肠输出道可以作为前列腺癌粒子植入术后肌层浸润性膀胱癌患者安全、有效的手术方式之一。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|