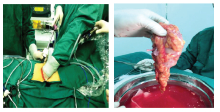
目的:探讨程序优化下后腹腔镜下左侧活体供肾切取术(LLDN)238例的临床经验及安全性。方法:选择2011年11月–2019年3月在中国人民解放军总医院第八医学中心移植外科由单一术者行后腹腔镜下左侧亲属供肾切取术的238例供者资料。手术常规取腰部3个穿刺点,采用程序化供肾切取的游离顺序:①充分利用肾周无血管解剖层面,首先游离肾脏腹侧面,快速显露肾静脉腹侧,然后从逆时针方向游离肾下极、输尿管、肾动脉和肾静脉背侧、肾上极,最后与肾静脉腹侧面汇合。在肾脏游离过程中完成血管属支的处理和输尿管的显露;②保留输尿管周围脂肪,尽可能保护输尿管的血供,游离输尿管至跨髂血管处剪断;③充分游离供肾及动静脉后,将腹侧Trocar切口延长5 cm,术者左手握住肾脏,牵引供肾血管,用Hem-o-lok分别夹闭肾动脉和肾静脉后剪断,迅速取出供肾交台下灌注及修整。结果:238例供肾切取手术均成功,无中转开腹及供肾废弃,供者100%安全。左肾动脉多支30例,其中2支25例,3支5例(3例全部术中吻合,2例第3支细小分支CTA未显影,术中偶然发现结扎废弃)。腔镜操作手术时间37~186 min,平均(73±22)min。热缺血时间1.1~4.5 min,平均(2.3±0.8)min。出血10~350 mL,平均(45±20)mL,均未输血。发生手术并发症6例,淋巴瘘1例,短期自愈,腰静脉损伤出血2例,被膜下血肿3例,均无严重并发症。术后住院时间5~10 d,平均(6.3土1.2)d。238例供者随访1~15个月,平均7个月,均健康。结论:程序优化下后腹腔镜下亲属供肾切取术安全可靠,可以降低学习曲线,提高供肾质量。
Objective: To discuss the experience and safety of program optimization of retroperitoneal laparoscopic left living donor nephrectomies for 238 consecutive cases.Methods: A total of 238 donors undergoing retroperitoneal laparoscopic left living donor nephrectomy from Nov. 2011 to March 2019 were selected. The operation was performed through 3 lumbar ports. The sequence of donor dissociation was routinized: (1) Make full use of the anatomic level of perirenal vasculature, first dissociate the ventral side of the kidney, quickly expose the ventral side of the renal vein, then dissociate the lower pole, ureter, renal artery and dorsal side of the renal vein, upper pole of the renal vein in the counterclockwise direction, and finally make peace with the ventral side of the renal vein. During the process of kidney dissociation, the treatment of vascular branch and ureter exposure were completed. (2) Retain the fat around the ureter, protect the blood supply of the ureter as far as possible, and free the ureter to cut it across the iliac vessels. (3) After the donor kidney and arteries and veins were fully freed, the ventral Trocar incision was extended for 5 cm. The operator held the kidney with his left hand, pulled the donor kidney vessels, and then Hem-o-lok was used to clip the renal arteries and veins respectively and cut them off. The donor kidney was quickly removed for perfusion and dressing under the stage.Results: The 238 operations were successful, and all donors were safe. There were 30 patients with multiple branches of the left renal artery, including 25 with two branches and 5 with three branches (3 cases were given intraoperative anastomosis, 2 cases had no CTA development of the third branch, and ligation was found to be abandoned by accident during the operation). The operative time was 37-186 min [mean (73±22) min]. The mean time of warm ischemia was 1.1-4.5 min [mean (2.3±0.8) min]. The bleeding was 10-350 mL [mean (45±20) mL]. No blood transfusion was performed. There were 6 cases of surgical complications, including 1 case of lymphatic fistula, obtaining short-term self-healing, 2 cases of lumbar vein injury bleeding, and 3 cases of subcapsular hematoma. There were no serious complications. Postoperative hospital time was 5 to 10 days, with an average of 6.3 days. 238 donors were followed up for 1 to 15 months, with an average of 7 months.Conclusion: It is safe and reliable to perform retroperitoneal laparoscopic living donor nephrectomy, which can reduce the learning curve and improve the quality of donor kidney.
供体短缺是世界性难题, 公民逝世后器官捐献(donation after cardiac death, DCD)虽然有一定进展, 但仍难以满足临床需要, 供需矛盾仍然突出。亲属间的活体肾移植作为家庭内的自救方式具有重要意义。在美国, 活体肾移植数量占到肾移植总数的50%左右, 并且取得了很好的效果[1]。目前随着腹腔镜微创手术的快速推广, 全国各移植中心基本上都开展了腹腔镜供肾切取术(laparoscopic living donor nephrectomy, LLDN), 如何最大限度减少并发症及死亡率、提高供肾质量成为目前肾移植的研究重点[2]。我院2011年11月– 2019年3月行程序优化下后腹腔镜下活体供肾切取术238例, 为保证质量, 所有手术为单一术者完成, 供肾切取手术全部成功, 效果良好, 现将临床经验总结报告如下。
选择2011年11月– 2019年3月在中国人民解放军总医院第八医学中心移植外科行后腹腔镜下亲属供肾切取术的238例供者资料进行研究, 其中男102例, 女136例, 年龄30~67岁, 平均(51.2± 6.8)岁。供受关系如下:兄弟姐妹之间供肾49例(20.6%), 父母给子女供肾182例(76.5%), 夫妻之间供肾6例(2.5%), 子女给父母供肾1例(0.4%)。供者BMI值平均(24.32± 3.42)(16.02~32.05)kg/m2。所有供者、受者均在伦理会签署知情同意书, 均为自愿无偿捐献且自愿参加术后随访研究。研究送达中国人民解放军总医院第八医学中心人体器官移植伦理委员会审核和备案, 并报请上级卫生行政机关核准。供者常规接受身体检查排除高血压、心脏病、活动性肺结核、糖尿病和慢性肝肾疾病等基础疾病。主要检查项目包括心电图、肺部CT、腹部超声、心脏超声、多参数大肾图及双肾CT血管和泌尿系三维重建[3]。
全麻后留置尿管, 取侧卧位, 调整手术床使腰部抬高, 常规术野消毒, 铺无菌单。腰部采用三套管法穿刺:第一穿刺点选在腋后线第12肋缘下, 纵向取1.5~2.0 cm切口, 使用大弯钳钝性分离肌层和腰背筋膜, 并在腹膜后脂肪游离出间隙, 置入球囊扩张器, 在腹膜后扩张2~3 min, 置入12 mm Trocar。第二穿刺点选在腋前线肋缘下, 置入5 mm Trocar。第三穿刺点选在腋中线髂棘上1.0 cm, 置入10 mm Trocar和300腹腔镜。
我们在前期开放供肾摘取术的基础上, 结合腔镜技术, 总结了一套程序优化腹腔镜下供肾切取方法, 既快速又安全, 其流程报告如下。
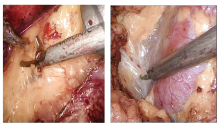
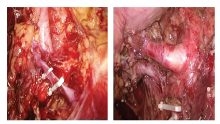
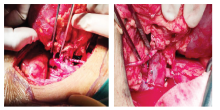
1.2.1 肾脏的游离 清理腹膜外脂肪, 靠近反折线打开Geota 筋膜, 在脂肪囊内完成肾脏腹侧面的游离(图1)。
1.2.2 脂肪囊内分离 于下极腹侧, 向下分离输尿管腹侧肾周脂肪与腹膜间的无血管层面(图2)。
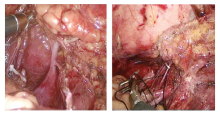
1.2.3 肾静脉的显露 转向肾门脂肪囊外, 拨开与腹膜间的无血管间隙层面, 显露肾静脉腹侧(图3)。
1.2.4 输尿管游离 分离输尿管外背侧肾周脂肪与腰大肌间层面, 完整保存了输尿管的血供(图4)。
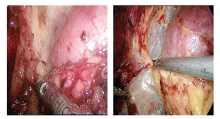
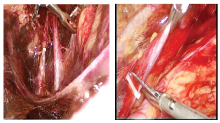
1.2.5 供肾动静脉的游离及淋巴管结扎 挑起输尿管及肾下极, 充分显露肾门, 以超声刀锐性分离为主, 重点处理肾静脉属支生殖静脉和腰静脉, 变异较多[4], 防止误伤。粗大淋巴管束通过Hem-o-lok处理(图5)。
1.2.6 肾上腺中央静脉离断 在肾上腺背外侧与肾上极脂肪间锐性分离(肾上极保留部分脂肪防止误伤动脉提前分支), 向下与最先显露的肾静脉汇合, 完成“ 会师” , 左肾上腺静脉肾静脉属支的离断采用远心端用小号Hem-o-lok夹闭, 近肾端丝线结扎的办法(图6)。
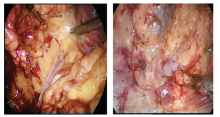
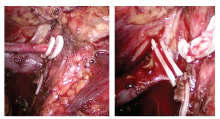
1.2.7 输尿管的离断 游离至髂血管交叉处, 尽可能保护好输尿管组织血供及脂肪组织。待肾脏游离完毕, 肾血管完全显露后, 用剪刀离断输尿管(图7)。
1.2.8 供肾动脉、静脉的离断 自第2穿刺点向脐部延长5~6 cm, 锐性切开腹外斜肌和腹内斜肌, 钝性分开腹横肌, 左手进入后握住肾脏和血管, 同时以左手腕部堵住手术切口以防气体泄漏, 分别在肾动脉、肾静脉近心端上2枚Hem-o-lok夹, 迅速剪断供肾动静脉(图8)。
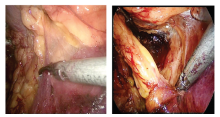
1.2.9 供肾取出、修整及灌注 迅速剪断供肾动静脉血管, 左手握住肾脏后, 迅速取出供肾交给修肾组, 用肾保存液灌注及供肾修整(图9)。
1.2.10 肾移植手术 供肾常规移植于受者右髂窝为主, 术后常规应用三联免疫抑制剂(CNI类+霉酚酸酯类+激素)。多支动脉的处理:2支血管粗细相当者分别与髂外动脉端侧吻合, 下极较细者与腹壁下动脉端端吻合。在2例3支血管者中, 术前CTA未发现肾上极细小支, 故吻合2根主支后结扎废弃细支(图10)。
所有LLDN手术均录像, 每例手术时间均从腔镜进入开始, 到肾脏游离完毕切取下来结束。
238例供肾腹腔镜取肾手术全部成功, 无中转开放手术。左肾动脉多支30例, 其中2支25例, 3支5例(3例全部术中吻合, 2例第3支细小分支CTA未显影, 术中偶然发现结扎废弃)。腔镜操作时间37~186 min, 平均(73± 22) min。热缺血时间1.1~4.5 min, 平均(2.3± 0.8)min。出血量10~350 mL, 平均(45± 20)mL, 均未输血。发生手术并发症6例:1例淋巴瘘短期自愈, 腰静脉损伤出血2例, 移植肾包膜下血肿3例, 均无严重并发症, 未输血。术后住院时间5~10 d, 平均(6.3土1.2)d。238例供者随访1~15个月, 平均7个月, 均健康。
①供肾多支动脉的处理:供肾2支血管粗细相当者分别与髂外动脉端侧吻合, 下极较细者与腹壁下动脉端端吻合。②根据术前受者的移植风险评估, 术前及术后主要应用巴利昔单抗免疫诱导。移植后1 d内常规给予CNI+抗代谢类药物+皮质激素的三联免疫抑制方案(CsA起始用量为6~8 mg· kg-1· d-1, Tac起始用量为0.1~0.15 mg· kg-1· d-1)。238例受者均成功完成肾移植手术, 术后恢复顺利, 其中仅3例发生移植肾功能延迟恢复, 1~3周后恢复正常, 余235例均于2周内恢复正常。肾移植术后2个月时有1例输尿管膀胱吻合口狭窄闭锁, 最后经输尿管镜处理顺利恢复出院, 考虑与游离输尿管过度裸化有关。
尿毒症是慢性肾功能衰竭的终末期, 肾移植目前被认为是治疗尿毒症的理想方法, 而供肾的日益短缺是目前肾移植面临的最主要问题之一[5]。活体供肾移植作为一个解决尿毒症患者移植肾的重要渠道, 已得到全世界的认可及推广。根据我国目前法规, 只有亲属间才能进行活体肾移植, 主要是指在具有密切血缘关系的直系和三代以内旁系血亲及夫妻之间的供、受者之间进行的器官移植, 由伦理委员会审核把关[6]。
活体供肾切取的经典方法是开放性供肾切取术。然而这种经典的方法创伤大, 也给潜在捐献者造成了一定顾虑[7]。随着腹腔镜微创技术的发展和手术医生技术的熟练, 我国越来越多的器官移植单位开展腹腔镜下亲属供肾切取术, 并取得了良好的效果。与传统的DCD肾移植相比, 活体腹腔镜供肾切取手术的肾移植人/肾存活率更高, 热缺血时间短、创伤小、出血少、平均住院时间短、术后康复快等优势; 但其微创技术要求高, 学习曲线也偏长; 由于亲属移植的特殊性, 术者较其他普通泌尿外科手术而言, 需担负更多的心理压力和移植手术风险[8, 9]。
我国目前腹腔镜供肾切取手术培训模式主要靠手术现场观摩和自学积累, 缺乏行业层面的标准化培训, 手术操作完全靠自己揣摩, 指导者与学习者之间的教学实践是建立在患者身上而非应用模型上, 也缺乏程序性的优化方案[10]。国内外开展腹腔镜下活体供肾切取术较早的单位多在腔镜下离断肾动静脉后再切开取肾, 热缺血时间为3~8 min, 平均4.5 min[11]。我们在熟练掌握腹腔镜下肾切除术的基础上, 总结了一套程序优化下腹腔镜供肾切取流程, 整体肾切除手术时间37~186 min, 平均(73± 22)min; 热缺血时间1.1~4.5 min, 平均(2.3± 0.8)min。出血10~350 mL, 平均(45± 20)mL, 术中均未输血, 而且随着手术例数及熟练程度的增加, 手术将更加安全、更加程序化, 供肾切取手术时间多数在在1 h以内; 热缺血时间一般控制在1.5 min以内, 出血量很少。程序优化后的供肾切取与传统供肾切取的手术相比, 有以下改进:①首先, 显露肾静脉腹侧面, 挑起输尿管和肾下极及分离肾动脉和静脉属支更加高效和安全, 处理肾上极时由于保留了部分脂肪, 且早已显露了肾静脉, 处理肾上腺静脉时更快捷和安全, 也不容易误伤动脉分支; ②改寻找输尿管为“ 保护” 输尿管。完全在脂肪囊外游离输尿管, 能更好地保护输尿管血供, 减少受者肾移植术后输尿管并发症; ③与常规腔镜下先离断血管后切口取肾对比, 术者左手先进入术野较直接腔镜下离断血管安全性更高:一方面有些高龄供者动脉血管硬化, 易发生如Hem-o-lok夹切割和滑脱等严重不良事件, 术者左手可迅速控制主干血管, 为中转开放手术赢得宝贵时间; 另外一方面热缺血时间更短, 且不增加供者创伤, 比起腔镜下离断血管, 术者在供肾切取过程中更加从容、自信和安全[8]。
目前供肾切取右肾还是左肾还存在争议[12]。大多数移植中心更喜欢使用左肾活体肾捐赠, 由于左侧肾静脉较长, 有利于移植肾血管吻合及供肾位置的摆放。然而, 一项单中心随机对照试验显示, 在供肾者住院时间、供肾者生活质量、供肾者和受者并发症发生率或移植物存活率方面, 左肾切除和右肾切除之间没有差异[13]。如果术前明确左肾3支以上血管, 应参照右肾情况权衡决定; 具体选择哪一侧行供者切取手术, 需要综合考虑供者分肾功能、双肾动静脉血管结构、术者熟练程度等因素来确定。
早期的研究表明, 多支供肾动脉的肾移植会增加血管和泌尿系统并发症的发生率, 如供肾血栓形成和输尿管缺血, 因此被认为是相对禁忌证[7]。然而最近的报道表明, 肾移植在多支动脉情况下也可以安全地进行, 在本研究中遇到的30例多支肾动脉中, 2支25例, 3支5例, 受者术后恢复好, 分支动脉均完好保存。需特别注意肾下极副肾动脉通常为移植肾的肾盂和输尿管提供充足的血液供应, 不能轻易废弃。由于肾脏静脉有侧支循环, 一般情况下大多数小口径副肾静脉可以安全结扎。国际上已有共识, 无论哪种亲属供肾切取多支血管的供肾手术都不是绝对禁忌[14]。
腹腔镜供肾切除术是一种较新的技术, 发展非常迅速, 已成为一种安全的微创手术方法。随着临床经验的增加, 各种早期腹腔镜供肾切除术的禁忌证, 如右侧供肾、多支血管、肥胖[15, 16]及老年供肾, 经过术前严格评估, 都已被克服。一方面得益于微创器械和技术的进步, 更重要的是基于一直将供者安全放在首要位置的理念、手术改进及流程优化, 减少了手术风险及并发症的发生率[8]。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|