目的:评价雷帕霉素靶蛋白(mTOR)抑制剂——依维莫司在侵袭性肾脏上皮样血管平滑肌脂肪瘤治疗中的疗效及安全性。方法:2014年10月–2017年10月,共有5例经病理诊断及临床特征判定为侵袭性肾脏上皮样血管平滑肌脂肪瘤患者接受依维莫司药物治疗,收集患者的临床信息,并对所有患者进行TSC1/2基因的高通量目标捕获二代测序。所有患者均接受了手术切除及依维莫司药物治疗,评价依维莫司的临床疗效及不良反应。结果:高通量二代测序检测到有临床意义的TSC2突变3例、TSC1突变1例,均为错义突变,另1例检测到TSC1的点突变。临床诊断与基因检测确定4例患者伴有结节性硬化。5例患者均接受依维莫司10 mg每日一次,治疗3~16个月,3个月时疗效评估:缓解4例、稳定1例,平均肿瘤最大直径从8.5 cm缩小为5.2 cm。随访3~20个月,目前4例病情稳定,1例用药16个月后出现疾病进展。伴有结节性硬化的患者疗效显著优于非结节性硬化患者。结论:对于不能完整切除、无法手术或合并远处转移的侵袭性肾上皮样血管平滑肌脂肪瘤患者,如果同时符合结节性硬化的诊断,应用mTOR抑制剂将获得良好的临床效果。
Objective: To study the feasibility and safety of Everolimus in the patients with invasive renal epithelioid angiomyolipoma (EAML).Methods: From Oct. 2014 to Oct. 2017, we retrospectively analyze the clinical data of 5 cases of invasive EAML given Everolimus, and next-generation sequencing (NGS) was performed to investigate the gene mutation of TSC. All patients received surgery and Everolimus treatment. The feasibility and safety were evaluated.Results: Pathogenicity TSC2 mutation was found in 3 cases and TSC1 mutation in one case by NGS, and all of the mutations were missense; the rest one had a nonpathogenic point mutation in TSC1 gene. Four patients were diagnosed as tuberous sclerosis complex (TSC) by clinical syndrome or gene examination. All patients received Everolimus (10 mg every day for 3 to 16 months). Four patients achieved partial response (PR) and one patient obtained stable disease (SD) after three-month treatment. The average max diameter of tumor was decreased from 8.5 cm to 5.2 cm. Follow-up time was 3 to 20 months. Four patients were SD, and one patient had progressed after treatment for 16 months. Patients associated with TSC had better response to Everolimus.Conclusions: For patients with invasive renal EAML which cannot receive radical tumorectomy or has distant metastasis, Everolimus may have good clinical efficacy if TSC diagnosis is made simultaneously.
肾上皮样血管平滑肌脂肪瘤(epithelioid anomyolipoma, EAML)为肾血管平滑肌脂肪瘤的少见亚型, 是一种来源于血管周上皮样细胞的间叶性肿瘤[1, 2]。肾EAML在临床少见, 文献多见于个案报道, 该类肿瘤具有恶性潜能并呈现高侵袭性生物学行为, 可发生局部复发、远处转移和死亡等情况[3], 目前仍无标准的治疗方案。本研究对中国人民解放军总医院2014年10月– 2017年10月收治的5例侵袭性肾上皮样血管平滑肌脂肪瘤进行包括手术和依维莫司药物的综合治疗, 取得了良好的临床效果, 现报告如下。
收集5例侵袭性肾EMAL患者的临床资料, 包括临床症状、肿瘤大小、病理学和影像学特点、手术方式及随访情况。5例患者均因肾肿瘤手术后复发或转移就诊, 男女比例为2∶ 3, 年龄27~60岁, 平均(39.8± 11.5)岁。左侧2例, 双侧3例。3例患者首次手术接受根治性肾切除, 2例首次手术接受肾部分切除。5例患者在首次手术后7~100个月后出现疾病进展, 中位至疾病进展时间30个月; 局部复发3例、多发转移2例; 其中2例复发患者均接受二次手术切除病灶, 1例远处转移患者行右肩胛骨转移灶切除术, 另2例患者未接受手术治疗。2例患者符合结节性硬化的临床诊断, 2例通过基因检测确诊为结节性硬化, 1例不伴有结节性硬化。所有患者病理诊断均为上皮样肾血管平滑肌脂肪瘤, 所有病例均为HMB45染色阳性, 其中病例1、3、5的Ki-67阳性率超过20%, 核分裂像超过2/10 HPF。病例2、4的Ki-67阳性率均为3%, 核分裂像均为1~2/10 HPF, 详表1。
| 表1 患者临床资料 |
1.2.1 目标序列捕获与测序 抽取受试者及对照者静脉血5 mL, 按标准流程提取基因组DNA(QIAamp DNA Blood Midi Kit, Qiagen, Hilden, Germany)。利用Covaris LE220超声波仪(Massachusetts, USA)将基因组DNA打断成200~250 bp的片段, 随后进行Ampure Beads纯化, 将纯化后的DNA片段进行末端修复、加“ A” 以及加接头反应, 从而完成单个受检者的DNA建库。Non-Captured样品进行LM-PCR反应, 纯化, 利用定制的基因片段捕获探针(BGI自主探针), 65℃杂交捕获24 h, 杂交结束后进行探针的洗涤和洗脱反应, 随后进行Captured样品的LM-PCR反应。文库经Agilent 2100 Bioanalyzer 和 ABI StepOne进行片段大小、浓度的检测, 最后利用高通量测序仪Illumina HiSeq2500 Analyzers(Illumina, SanDiego, USA)连续双向测序90个循环, 用Illumina Pipeline software(version 1.3.4)读出原始测序数据。
1.2.2 序列分析 数据下机后进入信息分析部分。首先对下机的原始数据(Raw reads)进行测序质量评估, 去除低质量以及被接头污染的数据。随后用BWA软件(Burrows Wheeler Aligner)与HG19进行序列比对, 与此同时进行序列捕获效果评价, 用SOAPsnp软件和Samtools软件分别进行SNV(single nucletide variant)和Indel(insertion and deletion)的查询, 生成目标区域碱基多态性结果, 随后进行数据库(NCBI dbSNP, HapMap, 1000 human genome dataset 和 database of 100 Chinese healthy adults)的比对, 并对找出的可疑突变进行注释、筛选。
1.2.3 Sanger法验证 对于所有发现的致病突变, 在其所在片段上下游设计引物, 进行PCR扩增, 并对产物做Sanger测序。将所得结果与TSC1和TSC2基因标准序列进行比对, 从而验证探针捕获和高通量测序的结果。
对所有患者给予依维莫司(诺华制药, 瑞士)药物治疗, 起始剂量均为10 mg口服, 1次/d, 连续用药。药物治疗直至疾病进展或者出现需要减量或停药的Ⅲ 级或Ⅳ 级药物不良反应。定期评估患者药物治疗的疗效、血药浓度及不良反应发生情况。
依维莫司治疗前, 所有患者均采用螺旋CT或者MRI测定肿瘤病灶, 以最大直径肿瘤作为靶病灶, 应用实体瘤评价标准判定疗效(RECIST 1.0)[4]。分别于治疗后第1、3、6、12个月进行疗效评价, 之后每6个月进行疗效评价。不良反应每周期进行评价, 按照《美国国立癌症研究所不良事件通用术语标准》(NCI CTCAR 3.0版2006年8月)进行分级[5]。依维莫司的血药浓度通过检测血清雷帕霉素血药浓度并通过公式换算得出[6]。
BWA软件行序列捕获效果评价显示, 所有样本NGS平均碱基覆盖度为99.88%, 最低样本覆盖度为99.44%。目标区域平均测序深度> 30X位点所占比例平均值为98.92%, 最低值为97.35%。所有样本的平均测序深度为280.4X, 最低测序深度为168.4X。而且TSCl和TSC2基因各外显子上的平均测序深度与测序深度中位数均比较接近, 表明目标序列捕获二代测序的随机性较好。
共检测到有临床意义的TSC2突变3例、TSC1突变1例, 均为错义突变, 另有1例患者检测到TSC1的点突变, 属于良性突变(表2)。通过对比以往文献及LOVD数据库MJ[7], 有1个临床意义未明确的突变, 病例1的TSC1外显子15的c.1700C> T错义突变。基因检测与临床诊断的符合率为60%(3/5)。
| 表2 患者TSC1/2基因二代测序结果 |
应用常规Sanger测序对5例NGS检测到5种突变位点进行验证, 其结果与目标序列捕获测序结果完全一致, 符合率100%。
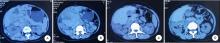
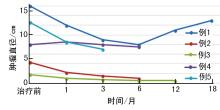
5例患者均接受口服依维莫司治疗, 治疗持续时间3~16个月, 治疗1个月时的初始疗效评估:PR4例、SD1例, 平均肿瘤最大径从8.5 cm缩小为6.4 cm; 治疗3个月疗效评估:PR4例, SD1例, 平均肿瘤最大径为5.2 cm(图1), 6个月时肿瘤直径变化不显著(图2)。随访3~20个月, 4例患者病情稳定, 1例患者用药16个月后出现疾病进展。4例通过临床诊断或基因诊断为结节性硬化的患者疗效显著优于不伴有结节性硬化的患者, 而是否伴有TSC1/2基因突变与依维莫司疗效间无显著相关性。
主要不良反应包括口腔黏膜炎5例、皮疹2例、贫血2例、月经失调2例、肝功能异常1例, 大部分为1~2级不良反应, 不需要停药或减低剂量, 给予对症处理后可缓解。1例患者用药9个月出现3级肝功能不全, 检测雷帕霉素血药浓度结果谷浓度为15.18 μ g/L, 换算依维莫司血药浓度为19.7 μ g/L, 暂停依维莫司并给予积极保护肝功能治疗后缓解, 遂重新开始依维莫司治疗, 剂量调整为5 mg口服, 1次/d, 复查依维莫司血药浓度为7.4 μ g/L。
肾EAML是一类比较罕见的肾脏肿瘤, 其发病率不到所有肾肿瘤的1%, 约占肾血管平滑肌脂肪瘤的4.6%[2]。该病好发于肾脏皮质, 成年女性多见, Aydin等[1]报道肾EAML患者较经典AML更趋于年轻化。与经典AML不同, 肾EMAL以上皮样细胞为主, 缺乏脂肪组织[8], 肿瘤多呈良性发展过程, 因此其临床表现缺乏特异性, 故肿瘤体积小时常无任何症状, 多由查体时偶然发现。肾EMAL术前诊断主要依赖于影像学检查, 但其影像学特征存在多种变化, 部分肿瘤呈侵袭性表现, 可侵犯邻近器官或远处转移, 容易造与其他类型肾肿瘤混淆而误诊。本研究组中有4例患者首次发病因腰痛就诊, 1例因血尿就诊, MRI检查均为乏脂肪占位, 其中2例临床诊断符合结节性硬化症表现。
肾EMAL具有独特的生物学行为, 其恶性诊断和预后参数尚无统一标准。2015年Lei等[9]依据肿瘤标本及病理学特点提出新的预测标准:①肿瘤直径大于9 cm; ②静脉瘤栓形成; ③上皮样细胞成分大于70%或不典型的分裂像细胞大于60%; ④发现坏死。当肿瘤符合至少3项视为有高度恶性生物学行为, 需要临床密切关注。Varma等[10]发现肾EMAL肿瘤P53阳性提示有恶性变的趋势, 并提出Ki-67、P53有助于该类肿瘤良恶性的评估。本组患者中所有病例均为HMB45染色阳性, 其中病例1、3、5均为多发转移, 其共同特点是Ki-67阳性率超过20%, 核分裂像超过2/10 HPF。而病例2、4的Ki-67阳性率均为3%, 核分裂像均为1~2/10 HPF。病例5年轻女性患者在人工流产后短时间内出现肿瘤快速进展, 值得关注。Tsai等[11]研究发现半数以上肾EAML伴有家族结节性硬化症(tuberous sclerosis, TSC)或其他部位的肿瘤。有报道称肾EMAL患者伴随结节硬化症的比例明显高于经典型肾AML, 20%~30%的青年肾EAML患者合并结节性硬化症[12]。本组患者均接受了TSC1/2基因检测, 4例发现致病性TSC1或TSC2基因突变, 其中2例符合结节性硬化临床诊断标准, 占同期我院诊断EAML患者的30.8%(4/13)。
肾EMAL目前的治疗方案没有统一规范标准, 手术切除是主要的有效治疗方式, 而完整的肿瘤切除可提高治疗效果[13]。在手术方式的选择上, 应根据患者肿瘤大小、位置、周围组织侵犯及远处转移等情况综合评估, 本组5例患者中3例在术后出现局部复发, 因此在术中彻底切除肿瘤尤为重要。目前部分学者研究发现肾EMAL对阿霉素、环磷酰胺、顺铂等化疗药物治疗有一定疗效, 同时也有个案报道肾EMAL对于放疗、化疗及分子靶向治疗均不敏感[14, 15, 16]。Kenerson等[17, 18]研究发现mTOR信号通路的异常激活在肾EAML的生长及进展中起重要作用, 部分患者应用雷帕霉素、依维莫司等mTOR抑制剂出现瘤体缩小, 说明mTOR抑制剂可对上皮样血管平滑肌脂肪瘤有一定的治疗作用。在一项多中心随机对照前瞻性临床研究(EXIST-2)中, 79例临床诊断为TSC相关EAML患者接受了6个月的依维莫司药物治疗, 42%的依维莫司组患者肾脏EAML病灶体积缩小> 50%, 而对照组未出现病灶体积缩小的病例[19, 20]。而依维莫司在侵袭性EAML治疗中的应用仅有个案报道[21, 22]。本组有4例患者考虑为结节性硬化相关的EAML, 给予依维莫司治疗1个月后瘤体明显减小, 肿瘤持续缩小至要治疗后6个月, 其疗效持续稳定达12个月, 目前仅有1例出现进展, 而另外1例非结节性硬化相关的EAML患者使用依维莫司后肿瘤变化不明显。我们选择了既往治疗结节性硬化相关肾血管平滑肌脂肪瘤的给药剂量10 mg/d作为初始剂量, 不良反应多为1~2级, 3~4级不良反应发生率低, 用药期间进行定期的安全性检查及血药浓度监测将有效避免严重不良反应的发生, 并可根据血药浓度进行合理的剂量滴定, 合理的药物滴定有助于患者长期安全地接受药物治疗。
综上所述, 侵袭性肾EMAL是一种具有恶性潜能的肿瘤, 完整的肿瘤切除是治疗的关键。对于术前评估难以完整切除或者术后出现疾病进展的患者应进行TSC1和TSC2基因突变分析, 对于存在致病性TSC1/2基因突变或临床诊断为结节性硬化的患者, 依维莫司的应用可以增加手术完整切除的概率, 还可以有效控制局部复发或者转移病灶, 其疗效还安全性还需要进一步的大样本前瞻性随机对照研究来证实。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|