目的: 探讨后腹腔入路机器人根治性肾切除联合静脉瘤栓取出术的安全性及可行性。方法: 入选4例瘤栓患者,2例为左侧肾癌伴静脉瘤栓(Mayo分级均为0级,301瘤栓分级均为0a级),2例为右侧肾癌伴静脉瘤栓(Mayo分级分别为Ⅰ级、Ⅱ级,301瘤栓分级均为Ⅰ级)(下文均为Mayo瘤栓分级)。手术采用经后腹腔入路,术中通过第三臂牵拉固定肾脏,制造操作空间,沿腰大肌深面显露并充分游离瘤栓所在下腔静脉段及各属支。对于左侧肾癌伴0级瘤栓,术中游离左肾静脉至肠系膜上动脉夹角处后离断左肾静脉。对于右侧肾癌伴Ⅰ级瘤栓,采用milk技术处理瘤栓近心端,利用Satinsky钳钳夹部分腔静脉侧壁,将瘤栓推回患侧肾静脉内,于肾静脉与下腔静脉交汇处离断右肾静脉,无须阻断下腔静脉。对于右侧肾癌伴Ⅱ级瘤栓,环形游离下腔静脉后依次阻断下腔静脉远心端、左肾静脉及下腔静脉近心端后剖开取栓,完整剥离瘤栓,重建下腔静脉。最后行肾根治性切除术。结果: 所有手术均经后腹腔入路完成,无中转开放手术。手术时间为110~210 min,平均158.75 min,术中估计出血量为200~1 000 mL,平均487.5 mL,无输血病例。术后放置引流管3 d,平均术后3 d拔除尿管,平均住院4 d。无术后出血、肺栓塞并发症发生。结论: 经后腹腔入路机器人根治性切除联合静脉瘤栓取出术安全、可行,为肾癌伴静脉瘤栓患者提供了一种有效的微创治疗方式,同时不同侧别的肿瘤具有不同手术适应证及技术特点。但其临床疗效及预后评价仍需扩大样量进一步验证。
Objective: To investigate the safety and feasibility of robot-assisted retroperitoneal nephrectomy with vena thrombectomy.Methods: Of four enrolled patients, there were two cases of left renal cell carcinoma with tumor thrombus and the Mayo grade 0 (grade 0a in the 301 classification system); one case of right renal cell carcinoma with the Mayo grade I; and one case of right renal cell carcinoma with the Mayo gradeⅡ (The latter two cases were of grade I in the 301 classification system). All operations were performed via the retroperitoneal approach. The third arm was used to fix the kidney to create the operation space. The IVC with tumor thrombus and its branches along the psoasmuscle were exposed and dissociated then. The renal vein was blocked by the Satinsky forceps at the proximal end of the tumor for the patients with Mayo grade 0 and grade I, and the tumor thrombus was pushed back into the renal vein. Then the Endo-GIA was placed at the junction of the renal vein and the IVC to disconnect the right renal vein. There was no need to disconnect the IVC. For the patients with tumor thrombus of Mayo grade I, venous branches of the IVC, the lumbar vein and the short hepatic vein were released and disconnected. The distal end of the IVC, the left renal vein, and the IVC near the cardiac end were sequentially blocked, and the thrombus was removed. The inferior vena cava was reconstructed and the above-mentioned occlusion band was released. After the blood vessel was not oozing, the operation was performed according to the radical nephrectomy procedures.Results: All operations were completed successfully via the retroperitoneal approach without conversion to laparotomy. The average operative time was 158.75 min (range from 110 min to 210 min). The intraoperative blood loss was estimated to be 487.5 mL (ranger from 200 mL to 1 000 mL) and no blood transfusion was needed. The drainage tube was placed for 3 days. The catheter was removed after 3 days. Patients were discharged 4 days after surgery. There was no bleeding, pulmonary embolism and other complications after surgery.Conclusions: Robot-assisted retroperitoneal nephrectomy with vena thrombectomy is safe and feasible, which provides an effective minimally invasive treatment for renal cell carcinoma with tumor thrombus, and there are different surgical indications and technical characteristics for different-sided renal cell carcinoma. However, the clinical efficacy and prognosis of this procedure still need to be expanded to confirm by a larger sample.
肾癌伴静脉瘤栓是泌尿外科手术难度最高的疾病之一, 开放的根治性肾切除术联合静脉瘤栓取出术是肾癌伴静脉瘤栓患者的标准术式[1, 2]。但开放手术同样有发生大出血或瘤栓脱落导致肺栓塞的风险[2, 3]。随着机器人手术的开展及手术技巧的提高, 对于Mayo分级为Ⅰ 、Ⅱ 级的肾癌伴静脉瘤栓患者, 机器人辅助腹腔镜下根治性肾切除联合静脉瘤栓取出术可取得与开放手术类似的远期肿瘤控制效果, 且具有更好的围手术期安全性[4]。经后腹腔入路手术解剖结构相对简单, 更容易显露肾门重要管道系统的结构, 已成为我国腹腔镜手术的主流入路[5]。现通过回顾性分析在中国人民解放军总医院完成的4例经后腹腔入路机器人肾根治性切除联合静脉瘤栓取出术的围手术期情况, 总结此类手术的临床经验。
4例入组患者均为男性, 年龄41~69岁, 中位年龄54岁。其中右侧肾癌伴静脉瘤栓2例, 左侧肾癌伴静脉瘤栓2例。4例患者术前经胸部CT、胸部平片及腹部超声检查, 其中1例行经导管下腔静脉造影、ECT全身骨扫描; 1例行MRI检查。1例术前胸部影像学检查提示左下肺转移灶。本组4例患者, 肾脏原位肿瘤最大直径为3.0~8.0 cm, 平均5.6 cm。2例患者为Mayo临床分级0级, 301瘤栓分级(以下简称301分级)均为0a级, 1例为Mayo临床分级Ⅰ 级(301分级Ⅰ 级), 另1例为Mayo Ⅱ 级(301分级Ⅰ 级)。1例患者术前辅以靶向药物治疗3个月:口服培唑帕尼胶囊, 800 mg, 1次/d。
以右侧肾癌伴静脉瘤栓患者为例, 手术采用经后腹腔入路, 麻醉成功后患者取完全左侧卧位, 抬高腰桥。手术应用达芬奇Si手术系统, 术中常规使用3个机械臂, 对于术前评估原发肿瘤较大、肾周组织粘连严重或Ⅱ 级瘤栓患者, 可加用第3臂协助暴露。Trocar位置如图1所示。首先于腋中线髂嵴上1~2 cm处做切口作为镜头通道, 扩开腰背筋膜, 用手指钝性分离, 建立腹膜后腔隙, 置入自制球囊扩张器, 注入300~400 mL空气扩张后腹腔空间。在肋缘与髂嵴连线中点与腋后线交汇处放置8 mm Trocar(机械臂2)。镜头孔放置12 mm Trocar后缝合固定, 连接气腹机, 气腹压力升至1.862 kPa(14 mmHg)。直视下经腋后线Trocar用吸引器向前正中线方向钝性推开腹膜, 沿机械臂2水平方向, 于腋前线腹侧1~2 cm置入8 mm Trocar(机械臂1)。分别于镜头孔和腹侧8 mm Trocar、背侧8 mm Trocar连线中点下6~8 cm处, 直视下放置2个12 mm Trocar作为辅助孔1、2。对接机器人操作系统, 自上向下清理腹膜外脂肪, 直视下于腹直肌外缘平机械臂1平面放置第三个8 mm Trocar(机械臂3)。左侧静脉瘤栓患者置管位置与右侧互为镜像。
右侧病例:对于Ⅱ 级瘤栓, 术中首先使用0° 镜, 将第1机械臂连接单极剪, 第2机械臂连接双极钳, 第3机械臂连接无创钳, 纵行剪开肾筋膜, 上至膈肌, 下至肾下极, 依次游离肾脏腹侧面、背侧面, 于肾后筋膜与腰大肌之间钝性分离, 将肾脏推向腹侧, 于肾门水平游离出肾动脉并夹断, 继续游离肾脏并离断输尿管。更换30° 镜, 通过第三臂牵拉以固定肾脏, 制造操作空间, 沿腰大肌层面暴露并环形游离瘤栓所在段的下腔静脉, 并充分暴露下腔静脉及左右肾静脉, 同时游离出腰静脉、肝短静脉和右侧肾上腺中央静脉等下腔静脉属支并离断。置入腔内超声探查瘤栓近、远心端, 以确保血管阻断带能安全地阻断下腔静脉近、远心端。阻断下腔静脉远心端、左肾静脉、下腔静脉近心端后依次剖开, 完整剥离瘤栓。采用4-0血管缝线重建下腔静脉, 松开上述阻断带, 检查腔静脉无血液外渗。将标本取出体外, 检查无活动性出血后, 依次缝合各层切口(图2)。
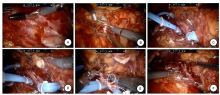 | 图2 切开下腔静脉取栓术 A:直视下置入机械臂3的Trocar; B:处理肾动脉; C:依次阻断下腔静脉远心端、左肾静脉、下腔静脉近心端; D:纵行切开下腔静脉壁取栓; E:重建下腔静脉; F:检查血管无渗血。 |
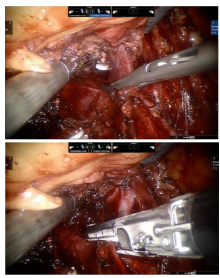
本组1例右侧Ⅰ 级瘤栓, 由于不需阻断下腔静脉, 术中向腹侧牵拉并抬举肾脏, 采用腔镜下Satinsky钳于瘤栓近心端阻断肾静脉, 将瘤栓推回患侧肾静脉内, 随后置入Endo-GIA于肾静脉与下腔静脉交汇处离断右肾静脉(图3)。
对于左侧肾癌伴0级静脉瘤栓患者, 体位、Trocar放置与右侧肾癌伴瘤栓患者类似。但术中游离并切断左肾动脉后, 需继续向深面游离并显露左肾静脉及其属支, 直至肠系膜上动脉夹角处, 以Hem-o-lok夹闭后剪断或使用Endo-GIA离断左肾静脉。
本组4例手术顺利完成, 无中转开放手术病例。手术时间为110~210 min, 平均158.75 min。术中估计出血量为200~1 000 mL, 平均487.5 mL, 未输血。仅右侧肾癌伴MayoⅡ 级瘤栓患者术中阻断下腔静脉, 时间为13 min。术后引流管放置时间与术后导尿管拔除时间均为3 d。平均术后住院时间为4 d。出院后患者伤口恢复情况良好。向病理科送检切除的标本, 4例患者术后病理结果均提示肾透明细胞癌, 送检淋巴结未见转移。围手术期未发生出血、肺栓塞等并发症。1例使用培唑帕尼术前靶向治疗后, 肺转移灶体积减小, 下腔静脉内瘤栓长度减小。术后大体标本及患者恢复情况见图4。
肾癌伴静脉瘤栓围手术期死亡率高达9.7%~22.2%, 是泌尿外科难度最大、风险最高的手术之一。Abaza教授[6]最早报道了机器人辅助腹腔镜静脉瘤栓手术的临床研究。Kundavaram, Gill和Ramirez教授也分享了机器人辅助腹腔镜下根治性肾切除及静脉瘤栓取出术的手术经验[7, 8, 9], 本单位也曾总结汇报该术式的方法及技巧[10, 11]。然而, 尚无后腹腔入路机器人根治性肾切除联合静脉瘤栓取出术的相关报道。
本研究中4例患者均经后腹腔入路途径完成手术, 分析手术经验, 并结合腹膜后的解剖特点, 我们认为对于Mayo Ⅰ , 部分Ⅱ 级(301分级I级)的右侧肾癌伴静脉瘤栓患者及Mayo 0级(301分级0a级)的左侧肾癌伴静脉瘤栓患者, 经后腹腔入路机器人根治性肾切除联合瘤栓取出术安全可行。手术的核心技术点为:①经后腹腔途径可更快, 更直接地显露肾动脉, 我们前期研究证实内侧弓状韧带可作为术中寻找肾动脉的解剖标志。对肾动脉的早期控制可减少肿瘤血供, 缩小肿瘤体积, 降低出血风险。②对于术前评估原发肿瘤较大、肾周组织粘连严重或Ⅱ 级瘤栓患者, 灵活使用3臂, 可通过牵拉制造操作空间, 术中可在充分解剖显露的情况下分离下腔静脉及左肾静脉、腰静脉等各属支, 降低了血管损伤的风险。③对于Ⅰ 级或长度较短的Ⅱ 级下腔静脉瘤栓, 用Satinsky钳将下腔静脉瘤栓推回至肾静脉内, 随后置入Endo-GIA于肾静脉与下腔静脉交汇处离断右肾静脉, 该术式不需阻断下腔静脉。
经后腹腔入路机器人手术相比经腹腔途径手术, 出血量较少, 同时可更清晰地显露后腹腔的外侧壁及后壁各解剖结构及腰静脉, 有利于游离并阻断腰静脉等下腔静脉属支, 减少血管损伤的风险。由于机器人手术系统的三维放大视觉和7个自由度的运动, 可更好地进行肾蒂的游离及肿瘤的切除, 同时减少肾脏的损伤, 更好地保护肾功能, 中转开放手术的概率更低[12]。经后腹腔途径手术与经腹腔途径手术相比, 热缺血时间及切缘阳性率无明显差别[13]。而后腹腔入路手术对腹腹腔脏器如肝脏、肠道等的刺激较小, 可减少术后胃肠道并发症及抗呕吐药物的使用, 且经后腹腔机器人手术具有术中出血少, 手术时间短等优势, 使患者围手术期恢复快[14, 15, 16]。经后腹腔机器人手术存在操作空间小, 肿瘤分离风险及肿瘤破裂的问题, 本研究中的4例患者, 肾脏肿瘤最大径为8 cm, 均经后腹腔机器人手术完成, 但是, 本研究为小样本量研究, 其有效性及适应证仍需更大样本量的研究来验证。同时, 对于肾脏原位肿瘤最大径大于10 cm且伴腔静脉瘤栓患者, 建议经腹腔入路完成。
后腹腔入路机器人根治性肾切除联合静脉瘤栓取出术具有严格的适应证。对于右侧肾癌伴静脉瘤栓患者, 经后腹腔入路机器人腹腔镜根治性肾切除术联合静脉瘤栓取出术对于瘤栓高度位于第一肝门以下水平的肾癌伴静脉瘤栓患者是可行的, 但对于瘤栓高度达到甚至超过第一肝门水平的病例, 仍需进一步探索该术式的可行性。而对于左侧肾癌伴静脉瘤栓患者, 若Mayo分级为0级且瘤栓高度未超过肠系膜上动脉水平者(301分级为0a)可经后腹腔入路完成该手术。由于经后腹腔途径入路手术为创造操作空间, 常需要更高的气腹压力, 虽然可减少切开取栓时的出血量, 但理论上也增加了静脉内瘤栓脱落的风险。对于左侧肾癌伴静脉瘤栓患者, 由于肠系膜上动脉横跨左肾静脉, 经后腹腔入路手术有损伤肠系膜上动脉的风险。因此我们认为, 对于左侧肾癌伴静脉瘤栓, 手术策略根据瘤栓近心端是否跨过肠系膜上动脉有所不同。此外, 本组研究样本量有限, 应根据随访数据及更大样本量的实践来评估其疗效; 对于原发肿瘤体积过大且伴I级静脉瘤栓的患者, 能否行经后腹腔途径机器人手术仍需进一步的临床研究。
综上, 对于Mayo Ⅰ 级或Ⅱ 级(301分级Ⅰ 级)右侧肾癌伴静脉瘤栓患者及Mayo分级为Ⅰ 级且瘤栓高度位于肠系膜动脉水平或以下(301分级0a级)的患者, 我们初步探索了后腹腔入路机器人根治性肾切除联合静脉瘤栓取出术安全性和可行性, 但其临床疗效仍需扩大样本量及完整的随访数据来进一步分析研究。
【编者按】肾癌伴静脉瘤栓取出术是泌尿外科风险较大的手术, 术中瘤栓脱落可造成肺动脉栓塞等致命性并发症。尽量避免围手术期瘤栓脱落诱因, 降低瘤栓脱落的风险是该手术重要的原则之一。后腹腔入路手术在显露肾动脉、控制出血方面具有优势, 但建立人工气腹的过程中有可能增加癌栓脱落的风险, 需严格掌握手术适应证。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|