前列腺穿刺活检是诊断前列腺癌的金标准。为提高穿刺的准确性,临床上常进行多针饱和穿刺,但这在提高诊断阳性率的同时也增加了术后感染、血尿、排尿困难等并发症的概率。在精准医学和人工智能蓬勃发展的今天,前列腺靶向穿刺技术应运而生。通过结合影像学、图像融合及人工智能等技术,前列腺靶向穿刺技术既减少了穿刺针数,又有效提高穿刺的准确性,同时减轻患者痛苦,是前列腺癌诊断领域的又一发展趋势。现就国内外前列腺靶向穿刺技术热点,如超声造影引导靶向穿刺技术、磁共振与经直肠超声融合靶向穿刺技术及两者与机器人相结合的机器人靶向穿刺技术的概况进行综述。
In recent years, the incidence of prostate cancer in China has been increasing. Prostate biopsy is the gold standard of diagnosis of prostate cancer. The main method to improve the accuracy of puncture is to conduct multi-needle saturation puncture. However, while improving the diagnostic rate, the method increases the postoperative complications such as infection, hematuria and dysuria. With the rapid development of precision medicine and artificial intelligence, prostate targeted puncture technology has come into being. By combining imaging, image fusion, and artificial intelligence technology, prostate targeted puncture technology can decrease the number of needle puncture, and effectively improve the accuracy of puncture. Besides, it can reduce patients' pain and sufferings, and is another trend in the field of diagnosis of prostate cancer. As well as discussing hot spots at domestic and abroad, this paper will review targeted prostate biopsy technology such as contrast-enhanced ultrasound to guide targeted piercing technology, magnetic resonance imaging/transrectal ultrasound fusion targeted biopsy and targeted piercing technology of robot combined with those two methods.
前列腺癌是男性常见的泌尿系统恶性肿瘤肿瘤, 其发病率居男性所有恶性肿瘤的第二位[1]。近年来, 我国前列腺癌的发病率呈逐渐增长趋势, 据统计, 在70岁以上的中国男性泌尿生殖系肿瘤中, 前列腺癌的发病率更是位居第一位[2]。前列腺癌的早期诊断和治疗是影响前列腺癌预后的重要因素, 自从1989年Hodge等[3]首次报道了经直肠超声(transrectal ultrasound, TRUS)引导下6针前列腺穿刺活检术, 以前列腺癌饱和穿刺为基础的相关研究得到了长足发展。有研究表明, 6针系统穿刺法的假阴性率比较高, 漏诊率最多可达20%, 而穿刺针数越多漏诊率越低[4]。为了提高阳性诊断率, 最简单的办法是不断增加穿刺针数, 随后出现8、10、12、13、14、18、20甚至22~24针的饱和穿刺技术[5, 6]。但随着穿刺针数的增加, 术后感染、血尿、便血等并发症发生的概率也随之增加, 同时更多临床无意义癌也会被检出, 造成过度的诊断和治疗。随着精准医学和人工智能的蓬勃发展, 机器学习和图像融合技术日益成熟, 使前列腺靶向穿刺成为了可能。靶向穿刺既能减少穿刺针数, 又能有效地提高穿刺的准确性, 还可以减轻患者痛苦及减少术后并发症, 成为又一前列腺癌诊断发展方向。超声造影(contrast-enhanced ultrasound, CEUS)靶向活检技术、磁共振与经直肠超声融合(magnetic resonance imaging -transrectal ultrasound, MRI-TRUS)靶向穿刺技术、机器人引导穿刺技术等随之出现, 本文就近年来国内外前列腺靶向穿刺技术发展进行概述。
CEUS是一种新型检查手段, 能有效地显示细小和低速血流, 还可动态观察血流动力学的变化。前列腺癌的生长依赖肿瘤血管的滋养, 肿瘤新生血管一般比较丰富且容易形成动静脉短路。通过微泡造影剂可使前列腺癌病灶的微小血管显影, 进而引导穿刺针进行靶向穿刺。Frauscher等[7]将CEUS技术用于前列腺穿刺活检, 研究得出CEUS可显示在常规超声中未显示的等回声病灶, 并且用CEUS引导进行前列腺靶向穿刺的单针阳性率为10.4%, 明显高于6点穿刺的阳性率(5.3%)。Koh等[8]比较了用CEUS进行靶向活检和12点系统穿刺每个穿刺针得到癌组织的概率, 发现前者的阳性检出率16.4%明显高于后者11.4%。我国也有学者将CEUS靶向穿刺和超声引导系统穿刺进行对比研究, 最终得出结论, 超声造影可以用于引导靶向穿刺活检, 提高穿刺的准确率及减少穿刺针数[9, 10, 11]。CEUS靶向穿刺在一定程度上提升了穿刺的准确性, 但其使用在一定程度上依赖于操作者的经验, 且超声图像的质量受影响因素较多, 提高病灶与正常组织的辨识度是进一步研究的方向。
人工神经网络式分析技术能够提高CEUS图像对肿瘤的辨识度。早在1999年, Loch等[12]就提出运用人工神经(artificial neural network analysis, ANNA)与超声影像学相结合的前列腺靶向穿刺技术, 并尝试构建人工智能经直肠超声(ANNA/computerized transrectal ultrasound, ANNA/CTRUS)靶向穿刺系统, 认为ANNA/CTRUS是前列腺穿刺技术的潜在发展方向。随后在2004年, Loch等[13]前瞻性地在217例患者中对6针系统穿刺和ANNA/CTRUS靶向穿刺进行了比较, 认为该系统具有较高的临床运用价值, 但需要进一步验证与完善。2007年, Loch等[14]再次通过类似研究, 认为前列腺癌穿刺的发展方向应为利用ANNA智能引导下针对性靶向穿刺, 而不是提高在前列腺癌检测中的随机活组织检查数。之后van Hove[15]及Tokas[16]等的报道进一步验证了ANNA智能辅助前列腺穿刺的可行性。通过近十年的发展, ANNA智能辅助下的超声引导穿刺已得到初步的验证, ANNA的自主学习功能使辨识超声图像下细微的病灶成为可能, 其中ANNA与超声造影相结合的研究目前尚未见报道, 可作为下一步研究的突破点。
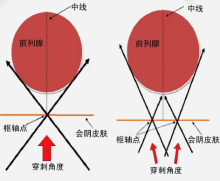
2011年, 新加坡的Ho等[17]报告了第一个关于超声引导的机器人(BioXbot)转导装置的临床试验, BioXbot可以根据前列腺的长度和体积自动为每个患者进行活检。BioXbot使用双锥形的穿刺范围来确保完成用最少的皮肤穿刺进入前列腺, 所有的针轨迹都通过一个枢轴点在1个前列腺波瓣内(图1)。因此, 整个前列腺都可以用2个皮肤穿刺点取样。BioXbot的缺点在于穿刺范围受耻骨弓的影响, 在前列腺容积为50 ml的试验病例中, 穿刺针无法到达前列腺的耻骨后部分进行针刺活检。另外, Long等[18]报告将三维超声机器人系统用于前列腺活检的最初经验, 该系统首次使用跟踪系统定位前列腺运动轨迹来引导穿刺, 最大程度上降低患者细微运动对靶向穿刺点定位的影响, 从而提高了穿刺的准确性。机器人系统的使用使穿刺操作中的稳定性、准确性有了进一步提高, 但是前列腺穿刺机器人的研制仍处于起步阶段, 距离临床实际运用仍有一段距离。
MRI对前列腺肿瘤探测的灵敏度高, 软组织的显示及多平面成像能力强。MRI引导下穿刺活检(MRI-TB) 又被称作MRI-MRI融合穿刺, 医师将扫描得到的T2WI信息与先前的MRI信息进行融合, 然后针对高度怀疑区进行靶向穿刺。使用这种穿刺方法的优势在于可以实时根据观察穿刺针的位置进行最准确定位并检测微小病灶, 确定病灶后只需进行几针穿刺, 且阳性率高[5]。其缺点在于医师需要接受额外的训练, 且穿刺活检需要与磁场高度兼容的设备。另外, 这种方法耗时较长、成本较高, 虽然有相关研究, 但目前在临床上难以得到广泛应用。
尽管MRI有其独特的功能, 但在扫描器内只能对患者进行有限的接触, 同时存在人手操作穿刺针调整和插入深度存在不确定性等问题。为了解决这个问题, MRI与机器人结合的技术应运而生。MRI与机器人结合的研究主要来自国外, 其最主要问题是需要研制与MRI磁场相兼容的气动马达。2007年, Stoianovici等[19]研发了一种完全与MRI兼容的气动步进马达, 并称之为PneuStep, 初步解决了MRI强磁场下的穿刺针动力问题。2012年, Seifabadi等[20]报告了所研制的五个自由度并联气动前列腺穿刺活检机器人, 医师可通过触觉和视觉的反馈来远程控制穿刺针的进针位置及角度。该机器人的定位精度显示平均误差为2.5mm, 穿刺针驱动的平均位置跟踪误差低于0.1 mm。
2017年, Stoianovici等[21]获得美国FDA的批准拥有六自由度的气动驱动MR Safe robot(MrBot)进行前列腺活检穿刺试验, 并在5例患者中成功完成穿刺。MrBot无需更正轨迹, 引导针刺的精准度为2.55 mm。此实践已证实, 可以使用机器人设备在磁共振扫描仪内空间限制下进行穿刺操作。但局限在于它的样本量过小, 还需要进行更多的研究, 以确定该机器人在临床实践中的作用。另外, 机器人的穿刺方法也有其局限性, 强磁场(1.5 T或更高)对手术设备、传感器、执行器和物理设备兼容性要求高, 这对设备的研制提出了更高的要求。
由于MRI引导下穿刺活组织检查需要特殊的设备, 耗时长、费用昂贵, 目前无法大规模推广。MRI-TRUS 融合成像可将两者优势相结合, 将术前磁共振成像和术中超声图像动态结合在一起, 既有TRUS方便灵活、实时显像的优点, 又有MRI对病变显示的高敏感性及特异性, 具有极高的临床价值。
2002年, Kaplan等[22]报道了将实时MRI-TRUS图像融合技术应用于前列腺靶向穿刺活检。随后国外大量学者对此技术的有效性及可行性进行探索, 并得出了肯定的结论, 尤其是首次穿刺活检阴性但高度怀疑前列腺癌的患者更应该进行此项检查[23, 24, 25, 26, 27]。在我国, 深圳大学医学部倪东等[28]对MR-TURS的理论进行了阐述并进行刚性模型试验, 认为MRI-TURS具有较高的穿刺精度, 其敏感度显著优于单纯经超声引导, 同时可降低操作的复杂度。
MRI-TRUS图像融合与机器人结合是目前前列腺靶向穿刺研究最前沿的领域之一。德国Kroenig等[29]报道了使用MRI-TRUS融合机器人引导的经会阴靶向穿刺和系统穿刺对前列腺癌检出率的比较研究。他们对52例PSA升高或怀疑为前列腺癌但12针系统穿刺法阴性的患者依次行MRI-TRUS融合靶向穿刺(135个可疑病灶共穿刺519针)和随机穿刺(共1 561针), 最终发现 MRI/TRUS融合靶向穿刺在高级别前列腺癌的总体确诊率上并不比随机穿刺有优势, 但随机穿刺要达到MRI-TRUS融合靶向穿刺的确诊率穿刺针数要增加到其4倍左右。类似的, Mischinger等[30]对MRI-TRUS辅助穿刺机器人和系统性穿刺进行了比较, 发现两者前列腺癌的检出率并无差异, 但前者的穿刺针数仅为后者的一半。虽然前期实验结果尚不理想, 这主要与实时超声图像与MRI图像融合的算法尚不成熟有关。但随着相关算法的成熟, MRI-TRUS图像融合以其实时、精确等优势, 结合机器人的稳定、高可控性, 将具有极高的临床运用前景。
经直肠超声引导下12针穿刺法仍是目前国内最常用的前列腺穿刺活检术式。目前国内大多数研究者仍将注意力集中在前列腺的不同穿刺针数对前列腺穿刺活检阳性率及术后并发症的比较研究, 靶向穿刺系统的研究在国内尚处于起步阶段。结合影像学、图像处理、人工智能等技术的靶向穿刺技术, 以其高精确性、较少的穿刺针数和较低术后并发症越来越受到重视, 国内也开始见相关研究报道。随着人工智能技术、图像融合算法等关键技术的进步, 交叉学科间的不断融合促进, 前列腺靶向穿刺技术将逐步成熟, 并对前列腺疾病领域产生深远影响。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|