目的: 探讨下腔静脉瘤栓切除术中下腔静脉离断的术前决策制定及其影响因素。方法: 回顾性分析中国人民解放军总医院泌尿外科2016年7月~2017年8月对8例下腔静脉瘤栓患者行下腔静脉离断术的临床资料。原发肾肿瘤7例,腹膜后恶性孤立性纤维肿瘤1例。左侧1例,右侧7例。Mayo分级Ⅱ级7例,Ⅲ级1例。301分级Ⅱ级7例,Ⅲ级1例。术前下腔静脉完全阻塞7例,5例合并远心端长段血栓。术前行下腔静脉造影示侧支循环充分建立。下腔静脉离断的方式包括完全离断和部分离断。对于右侧肿瘤,瘤栓高度在第二肝门以下,下腔静脉离断后不需要重建。对于高度达第二肝门以上的右侧瘤栓,可部分离断腔静脉。对于左侧下腔静脉瘤栓合并远心端长段血栓,手术方法为离断右肾静脉水平以下的下腔静脉,重建右肾静脉水平以上的下腔静脉。结果: 所有手术均采用机器人辅助腹腔镜下腔静脉瘤栓切除术。其中下腔静脉完全离断7例,部分离断加腔静脉重建1例。中位手术时间290 min(250~470 min),中位术中出血1 600 ml(700~6 000 ml),所有患者均给予术中输血,中位输血量1 025 ml(450~3 880 ml)。术后均转入ICU监护治疗,ICU中位住院天数4 d(1~6 d)。术后病理类型肾细胞癌5例,肉瘤2例,恶性孤立性纤维性肿瘤1例。术前肌酐中位值95.8 μmol/L(58.7~174.5 μmol/L),术后3~6个月中位血肌酐99.7 μmol/L (70.0~162.3 μmol/L)。术后3例患者出现暂时性双下肢水肿。所有患者均顺利出院,无围手术期死亡病例。术后中位住院天数8.5 d(5~30 d)。术后随访,4例患者出现远处转移,其中2例死亡,中位随访时间11个月(4.5~15.0个月)。结论: 下腔静脉离断在腔静脉瘤栓切除术中安全可行。术前下腔静脉造影有助于判断侧支循环建立情况以及离断决策的制定。根据瘤栓高度,肿瘤侧别,腔静脉阻塞及侵犯程度,侧支循环建立情况制定不同的离断策略。
Objective: To explore preoperative decision-making and influencing factors for inferior vena cava (IVC) transection during inferior vena cava thrombectomy.Methods: Eight patients with venous tumor thrombus underwent IVC transection from July 2016 to August 2017. There were 7 cases at right side and 1 case at left side. Primary tumor type was renal cell carcinoma in 7 patients and retroperitoneal malignant solitary fibrous tumor in 1. There were 7 cases of Mayo level Ⅱ and 1 case of level Ⅲ thrombus. Cases of level Ⅱ and level Ⅲ thrombus according to the "301" classification were 7 and 1, respectively. Preoperative imaging study revealed that the IVC was completely occluded in 7 cases and distal bland thrombus in 5 cases. Preoperative venography demonstrated robust collateral veins were established. For right cases with Mayo level Ⅰ-Ⅱ thrombus, the IVC was ligated and transected without reconstruction. For the cases of Mayo level Ⅲ-Ⅳ thrombus, the IVC was ligated and transected below the second porta hepatis; The IVC above the second porta hepatis was cut and then sutured after removal of the thrombus. For left cases, the IVC was ligated and transected at infra-renal vein level; the IVC above the right renal vein was cut and reconstructed after removal of the thrombus.Results: All cases were given the robotic surgery. Median operation time was 290 min. Median blood loss was 1600 mL. Median blood transfusion was 1025 mL. Median intensive care unit stay was 4 days. Median preoperative serum creatinine was 95.8 μmol/L (58.7-174.5). Median serum creatinine at 1st to 3rd month during the follow up period was 99.7 μmol/L (70.0-162.3 μmol/L). The mild transient lower extremity edema occurred in 3 patients and recovered within one month. No perioperative death occurred. Distant metastasis occurred in 4 patients postoperatively, resulting in 2 deaths. Median follow-up time was 11 months.Conclusions: IVC transection is safe and feasible during robotic venous thrombectomy. Venography is essential to ide.pngy the collateral vessels and help in preoperative decision making. According to tumor thrombus extent, primary tumor side, vena cava obstruction, venous wall invasion, establishment of collateral circulation, different strategies could be developed preoperatively.
肾癌伴下腔静脉瘤栓占肾癌的4%~10%[1], 手术难度大、风险高, 瘤栓易脱落。目前, 下腔静脉瘤栓切除术仍是治疗肾癌伴下腔静脉瘤栓的首选治疗方案[2], 而下腔静脉的处理和重建则是瘤栓切除术中最具挑战的部分之一。对于下腔静脉完全梗阻, 合并远心端长段血栓, 下腔静脉壁受侵犯, 以及肿瘤和静脉壁严重粘连的情况, 建议结扎或整体切除含瘤段下腔静脉[3, 4, 5, 6]。既往文献报道中, 离断下腔静脉多是因为术中被动选择[5], 术后并发症发生率较高, 因而离断下腔静脉后是否需要重建存在广泛争议。我院2016年7月~2017年8月行机器人辅助腹腔镜下肾癌伴下腔静脉瘤栓切除术中, 8例患者完全或部分离断下腔静脉且未行血管替代重建, 近期效果满意, 现将术前决策的制定、离断指征、手术策略、并发症以及围手术期结果报告如下。
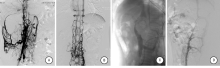
本组患者8例, 男4例, 女4例, 年龄40~67岁, 中位值59.5岁。BMI为23.5~32.5 kg/m2, 中位值25.7 kg/m2。原发肾癌7例, 腹膜后恶性孤立性纤维肿瘤1例, 左侧1例, 右侧7例。肿瘤大小6.5~10.0 cm, 平均7.3 cm。临床分期T3bN0M0 6例, T3bN1M0 1例, T3bN0M1 1例。术前1例合并腹膜后淋巴结转移, 1例合并胸膜及腹腔等远处转移。根据2004版Mayo分级标准评估[7], 下腔静脉瘤栓高度MayoⅡ 级7例, MayoⅢ 级1例。按照肾肿瘤伴静脉瘤栓“ 301分级系统” 标准评估[8], Ⅱ 级7例, Ⅲ 级1例。瘤栓长度4.5~13.5 cm, 平均7.9 cm。术前1周之内复查MRI或CT, 明确瘤栓高度、下腔静脉梗阻以及合并血栓情况。8例患者中, 影像学检查示合并远心端长段血栓达髂总静脉及以下者5例, 下腔静脉完全梗阻7例, 术前栓塞3例。所有患者术前行下腔静脉造影检查, 提示下腔静脉侧支循环建立充分。
根据肿瘤的侧别和瘤栓高度 (Mayo 分级), 手术方法和策略有所不同。我们之前报道了左右侧肾癌合并下腔静脉瘤栓不同的处理方式和详细步骤[9, 10], 本组病例患者体位、Trocar分布以及下腔静脉的显露方法与之前报道相似。
对于右侧肾癌合并Mayo Ⅰ ~Ⅱ 级下腔静脉瘤栓, 7例中2例患者于术前1~2 h行肾动脉栓塞。按照之前报道的手术方法, 根据不同的瘤栓高度, 充分显露下腔静脉[10]。游离并且裸化近心端下腔静脉后, 置入血管束带预阻断下腔静脉。置入机器人术中超声装置, 明确瘤栓上极水平, 确保瘤栓上极与血管束带之间有足够的空间置入直线切割器(图1A、B)。用直线切割器离断下腔静脉近心端(图1C、D)。然后, 游离并且离断左肾静脉。再次置入机器人术中超声装置, 确定瘤栓下界以及主要侧支血管的起点(图1E、F), 将切割闭合器置于瘤栓下界与侧支血管之间, 离断下腔静脉(图1G、H)。如果瘤栓下界与侧支血管之间距离太近, 无法放置切割闭合器, 可用阻断钳阻断下腔静脉远心端, 于侧支血管和瘤栓下界之间切开并且离断下腔静脉, 下腔静脉远心端用血管线缝扎, 防止损伤主要侧支血管。最后, 离断右肾动脉并行右肾根治性切除术。将切除的右肾及含瘤段下腔静脉整体切除并置入标本袋中。
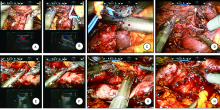 | 图1 离断下腔静脉 A:术中超声确定瘤栓上界; B:IVC近心端置入血管束带; C、D:切割闭合器离断IVC近心端; E、F:术中超声确定瘤栓下界及主要侧支血管起点; G:切割闭合器离断IVC远心端; H:主要侧支血管安全保留。 |
对于右侧肾癌合并Mayo Ⅲ 级的下腔静脉瘤栓, 在第二肝门以下水平结扎和离断下腔静脉。在阻断第一肝门, 第二肝门以及近心端下腔静脉后, 切开膈下段下腔静脉取栓并且缝合重建。
对于左肾肿瘤合并下腔静脉瘤栓, 于术前1~2h行肾动脉栓塞。显露近心端下腔静脉操作步骤与右侧类似。其次, 充分游离并且用切割闭合器离断含瘤栓的左肾静脉。如果远心端合并长段血栓且下腔静脉造影提示侧支循环建立, 则可于肾静脉水平下结扎离断远心端下腔静脉。肾静脉水平以上切开取栓并缝合重建下腔静脉。最后更换体位行左肾根治性切除术。
所有手术均行机器人辅助腹腔镜下腔静脉瘤栓切除术, 其中1例Mayo Ⅲ 级瘤栓采用手辅助腹腔镜切除第二肝门水平以上段下腔静脉瘤栓。手术时间250~470 min, 中位手术时间290 min。术中失血量700~6 000 min, 中位失血量1 600 ml。8例患者均行术中输血, 中位输血量1 025 ml(450~3 880 ml)。所有患者术后均转入ICU监测生命体征, 中位ICU住院天数4 d(1~6 d)。中位术后住院天数8.5 d(5~30 d)。术前血肌酐95.8 μ mol/L (58.7~174.5 μ mol/L), 术后7 d血肌酐97.4 μ mol/L(62.5-151.0 μ mol/L), 术后3~6个月中位血肌酐99.7 μ mol/L(70.0~162.3 μ mol/L)。术前血红蛋白110.5 g/L(68.0~128.0 g/L), 术后7 d血红蛋白95.0 g/L(72.0~109.0 g/L)。引流管留置7 d(4~11 d), 术后卧床5 d(2~7 d), 术后禁食4 d(3~8 d)。术后病理诊断:5例肾细胞癌, 其中2例合并肉瘤样变; 2例肉瘤, 1例恶性孤立性纤维瘤。未见切缘阳性。
术后并发症:根据Clavien手术并发症分级系统标准, 术后发生GradeⅠ -d级并发症3例, Grade Ⅱ 级2例。3例患者出现术后暂时性下肢水肿[11], 均在术后1个月内恢复正常。2例患者接受术后输血治疗, 所有患者均顺利出院。
术后随访:4例患者出现复发或进展, 其中2例患者死亡。1例患者术后5.5个月死于肝脏转移, 1例患者术后4.5个月死于多脏器转移。中位随访时间11个月(4.5~15.0个月)。
既往文献报道, 下腔静脉是否需要切除或离断通常根据术中情况作出被动选择[5, 12], 下腔静脉切除的指征包括静脉壁侵犯, 肿瘤与血管内皮严重粘连, 腔静脉管腔完全梗阻以及存在远心端长段血栓[4, 5, 6]。此外, 瘤栓的质地也是影响因素之一。而下腔静脉切除后是否需要重建目前还存在较大争议。下腔静脉重建的方式包括直接缝合修复, 血管补片修复以及血管移植重建等方式[13]。而移植重建下腔静脉的不足包括血栓形成, 严重的双下肢水肿, 肺栓塞, 需要长期服用抗凝药物, 以及血管外科医生的参与手术, 手术复杂, 时间长, 额外风险高, 移植血管长期有效率低[4, 13, 14]。因此, 基于完善的术前评估, 在术前有计划性的制定离断下腔静脉的决策尤为重要。
Ciancio等[3, 12]报道了肾癌合并下腔静脉瘤栓切除术中离断下腔静脉后的近期手术效果, 认为在侧支循环充分建立的情况下离断且不重建下腔静脉是安全可行的, 但是其仅仅根据影像学下腔静脉完全梗阻以及术前双下肢无水肿的表现假定侧支循环建立丰富[12]。另有研究认为, 仅根据这些术前体征和影像资料来假定侧支循环的充分建立通常具有误导性, 大约只有40%的患者与术前假设相符[4, 15]。因此, 术后并发症发生率较高。我们的经验也表明, 单纯通过MR/CT检查和术前体征判断下腔静脉是否完全梗阻以及预测侧支循环的建立情况并不准确, 而通过术前下腔静脉造影能够明确下腔静脉梗阻程度以及侧支循环建立情况。下腔静脉造影及术中腔内超声还有助于判断离断节段, 保护已建立的侧支循环主干(图2)。术前通过影像学检查, 对于符合离断适应征并且伴有充分的侧支循环, 且无严重心, 肝, 肾功能不全的患者可完全离断下腔静脉。
下腔静脉离断策略选择的的影响因素包括:①下腔静脉管腔阻塞程度, ②侧支循环建立情况, ③是否侵犯下腔静脉壁, ④原发肿瘤位置(左/右侧), ⑤是否合并远心端血栓。目前对于肾癌合并下腔静脉瘤栓的病例, 术前判断下腔静脉壁是否浸润尚无明确标准。梅奥医学中心的一项研究认为术前肾静脉入口处扩张(前后径≥ 24.0 mm)是预测腔静脉壁侵犯的高危因素, 同时下腔静脉完全梗阻以及右侧肾癌的病例下腔静脉切除率更高。对于远心端合并长段血栓无法完整切除的病例, 结扎或离断肾静脉水平以下下腔静脉是处理方式之一[16]。此外, 左肾静脉有充足的侧支回流, 离断下腔静脉后不会对左肾功能造成较大影响。而右肾静脉的侧支较少, 主要通过下腔静脉回流。因此在左侧肾癌合并下腔静脉瘤栓切除时, 须考虑右肾静脉的回流及对肾功能的保护。
下腔静脉离断的方式包括完全离断和部分离断加腔静脉重建。对于右侧肿瘤, 瘤栓高度在第二肝门以下, 下腔静脉离断后不需重建。用直线切割器依次离断瘤栓近心端, 远心端和左肾静脉。对于高度达第二肝门以上的右侧瘤栓, 可部分离断腔静脉。手术方法为离断第二肝门以下的含瘤段下腔静脉, 第二肝门以上的下腔静脉切开取栓并且缝合重建。对于左侧下腔静脉瘤栓合并远心端长段血栓, 手术方法为离断右肾静脉水平以下的下腔静脉, 重建右肾静脉水平以上的下腔静脉。
下腔静脉瘤栓切除术中一项高致死性因素为近心端血栓或瘤栓脱落导致的肺栓塞。我们的技术优势在于充分显露下腔静脉近心端后, 第一时间离断下腔静脉近心端, 然后再处理肾静脉及下腔静脉远心端, 因此能最大程度上降低瘤栓脱落致死的风险。其他优势包括:①最大化遵循无瘤原则。不切开下腔静脉, 避免钳夹及切开瘤栓, 特别是对于鱼肉样质地的瘤栓, 可以有效防止肿瘤播散。此外, 对于瘤栓侵犯腔静脉壁, 一并切除含瘤段下腔静脉, 防止肿瘤复发及转移。②缩短手术操作时间, 减少术中出血, 降低手术风险。③术前腔静脉造影以及术中多普勒超声的应用, 可以安全保留已建立的主要侧支循环, 保证下肢及重要脏器的血液回流, 维持循环稳定。⑤制定术前决策并且评估下腔静脉离断的可行性, 避免术中临时决定, 防止血管移植所造成的并发症。
本组患者中3例患者术后出现暂时性下肢水肿, 均在术后1个月内恢复正常, 可能与下腔静脉侧支循环进一步建立和完善相关。出院后随访, 所有患者均未出现严重的循环障碍。出院后复查下腔静脉造影, 同术前比较未见明显差异, 主要侧支血管得以安全保留。说明下腔静脉离断在特定指征的患者中应用是安全可行的。侧支循环的建立和保护可以避免出现严重的血流动力学障碍。
综上所述, 下腔静脉离断在腔静脉瘤栓切除术中是安全可行的。术前下腔静脉造影有助于判断侧支循环建立情况以及离断决策的制定。结合下腔静脉造影结果, 术者根据瘤栓高度, 肿瘤侧别, 腔静脉阻塞及侵犯程度, 侧支循环建立情况制定不同的离断策略, 更精准地完成手术。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|