目的: 探讨机器人肾脏切取、离体肾肿瘤切除及机器人自体肾移植术治疗复杂多发肾肿瘤的可行性。方法: 2018年1月15日完成1例机器人肾脏切取,离体肾肿瘤切除及机器人自体肾移植术。结果: 手术顺利完成,手术总时间7 h 10 min,肾脏热缺血时间1.5 min,冷缺血时间3 h 30 min,肾静脉吻合时间10 min,肾动脉吻合时间11 min。共切除肿瘤6枚,病理均为嫌色细胞癌。无围手术期并发症,术后9 d及1个月血肌酐分别为96.7、87.1 μmol/L,术后1个月CT示移植肾功能形态良好。结论: 机器人肾脏切取,离体肾肿瘤切除及机器人自体肾移植术可治疗复杂多发肾肿瘤,值得进一步探索及优化。
Objective:To investigate the feasibility of robot-assisted laparoscopic nephrectomy, ex-vivo hypothermia bench nephron-sparing surgery and robot-assisted laparoscopic renal autotransplantation to treat complex renal masses.Methods:One patient underwent robot-assisted laparoscopic nephrectomy, ex-vivo hypothermia bench nephron-sparing surgery and robot-assisted laparoscopic renal autotransplantation at January 15th, 2018.Results:Total operation time was 7 h 10 min. The warm ischemia time was 1.5 min and the cold ischemia time was 3 h 30 min. The operation time of venous anastomosis was 10 min and the time of artery anastomosis was 11 min. Six left renal masses were resected, and chromophobe renal carcinoma was diagnosed pathologically. The serum creatinine was 96.7 and 87.1 μmol/L at the 9th and 30th day postoperatively. Autograft function showed by CT was normal 1-month after the operation.Conclusions:The robot-assisted laparoscopic renal autotransplantation with ex-vivo hypothermia bench nephron-sparing surgery can be used to treat complex renal mass and further optimization is needed.
自体肾移植术1963由Hardy等[1]首次报道, 现已广泛应用于输尿管损伤、肾脏肿瘤、输尿管癌、肾动脉狭窄等多种疾病的治疗[2]。目前, 国外学者已报道了3例机器人辅助腹腔镜自体肾移植术治疗输尿管疾病[3, 4, 5], 但应用该技术治疗肾脏肿瘤未见报道。我们于2018年1月15日成功完成了1例机器人辅助腹腔镜左肾切取、离体低温工作台肾肿瘤切除及机器人辅助腹腔镜自体肾移植术, 现报告如下。
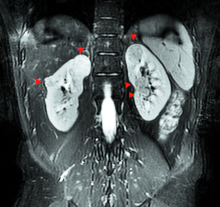
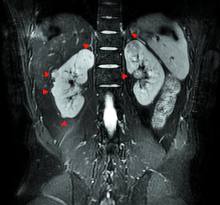
患者, 男, 32岁。BMI为22.5 kg/m2, 因“ 体检发现左肾占位2月余” 入院。2个月前曾在我院行机器人辅助后腹腔镜右肾部分切除术, 共切除肿瘤5枚, 病理均为嫌色细胞癌, 术后恢复良好。此次术前血肌酐为86.1 μ mol/L, 术前检查无手术禁忌。术前MRI影像资料见图1~4。
1.2.1 机器人辅助腹腔镜左肾切取 机器人辅助腹腔镜肾脏切取步骤参照文献[6], 作6 cm绕脐腹部切口取出肾脏。
1.2.2 离体低温工作台肾肿瘤切除及肾脏修补 肾脏取出后, 迅速经肾动脉注入4℃保存液, 至肾静脉流出清亮液体。修剪肾周脂肪, B超定位切除3枚内生性肿瘤, 另外切除3枚术前影像学未发现的肾脏表面微小肿瘤。肿瘤大小分别为3.0 cm× 2.5 cm× 2.0 cm、2.6 cm× 2.5 cm× 1.0 cm、1.5 cm× 1.5 cm× 1.2 cm、0.8 cm× 0.6 cm× 0.5 cm、0.3 cm× 0.2 cm× 0.2 cm、0.3 cm× 0.2 cm× 0.2 cm。可吸收线缝合创面, 经肾动脉灌注保存液后创面无明显渗液。结扎分支血管, 修整血管及输尿管断端。将肾脏装入纱布袋内, 填塞冰屑, 纱布袋相应部位剪口显露肾动静脉。
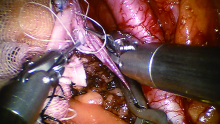
1.2.3 机器人辅助腹腔镜自体肾移植 患者取截石位, 头低脚高, 将自制PORT置于腹部切口, 并于PORT上放置Trocar作为镜头孔。取平脐左侧外8、16 cm及右侧外8 cm处作切口分别为机器人手术系统第1~3操作孔并置入相应器械, 取平脐右侧外16 cm处作切口为辅助孔。充分游离右侧髂外动静脉。通过腹部切口将肾脏放置在盆腔右侧, 肾动静脉正对右侧髂外动静脉。血管夹阻断右侧髂外静脉, 纵行剪开静脉壁, 肾静脉和右侧髂外静脉端侧吻合(图5), 采用GoreTexCV-6缝线固定一针后连续缝合, 闭合吻合口前使用肝素生理盐水冲洗管腔。采用相同方法及缝线作肾动脉和右侧髂外动脉端侧吻合(图6), 夹闭移植肾动脉及髂外动脉远端后轻松髂外动脉近端血管夹, 使血液充盈吻合口, 试验吻合口无渗血后开放动静脉, 即刻分泌尿液。经尿管注水充盈膀胱, 游离膀胱右前壁, 输尿管内留置双J管, 采用膀胱外黏膜下隧道法吻合膀胱输尿管。检查术野无活动性出血, 清点器械敷料无误, 于右侧外切口引出乳胶引流管1根, 拔除Trocar。逐层缝合切口。
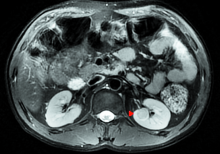
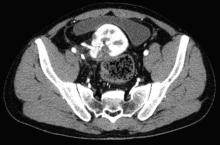
手术完成顺利, 手术时间共7 h 10 min, 肾脏热缺血时间1.5 min, 冷缺血时间3 h 30 min, 肾静脉吻合时间10 min, 肾动脉吻合时间11 min。共切除肿瘤6枚, 病理检验均为嫌色细胞癌。无围手术期并发症, 术后3 d进饮食, 4 d拔除盆腔引流管及尿管, 术后9 d及1个月血肌酐分别为96.7、87.1 μ mol/L, 术后1个月CT示移植肾功能形态良好(图7、图8)。
双侧肾肿瘤或孤立肾肾肿瘤是肾部分切除术的绝对适应证[7], 但最终能否行肾部分切除术, 取决于肿瘤的数目大小部位、术中肾脏热缺血时间以及术后可保留正常肾脏组织的大小。部分多发复杂双肾肿瘤或复杂孤立肾肿瘤因无法控制手术热缺血时间或保留足够的正常肾组织, 难以在体内原位行肾部分切除术[8]。在严格掌握手术适应证的前提下, 自体肾移植术联合离体低温工作台肾部分切除术可作为治疗多发复杂双肾肿瘤或复杂孤立肾肿瘤的最后手段[9, 10]。
自体肾移植术治疗肾脏肿瘤包括肾脏切取、离体低温工作台肾肿瘤切除及肾移植术三步, 其优势在于:①肾脏低温保护可将热缺血时间转变为冷缺血时间, 减少肾缺血再灌注损伤, 获得充裕的手术时间; ②手术视野无盲区无污染, 同时使用超声定位, 可精确切除肿瘤, 降低切缘阳性风险, 并保留较多的正常肾组织; ③低温保存液灌注肾脏可观察血管和集合系统的损伤程度, 对肾脏创面进行精细修整, 降低术后出血风险; ④肉眼还可发现术前影像学无法诊断的肾表面微小肿瘤[8, 11]。
目前自体肾移植术标准术式是腹腔镜肾脏切取联合开放肾移植术[12], 但该术式需腰部及下腹部两个手术切口才能完成, 患者创伤较大。机器人手术作为一种全新的微创手术方法, 已成为泌尿外科手术的重要组成部分[13, 14]。其中, 机器人辅助腹腔镜活体肾脏切取术已广泛应用[6], 机器人辅助腹腔镜异体肾移植术也已在少数移植中心常规开展[15, 16, 17, 18, 19, 20, 21]。在此基础上, 我们设想能否将机器人在这两方面优势结合, 进一步减轻自体肾移植患者的手术创伤。本资料患者为双肾多发肿瘤, 右肾虽然有5枚肿瘤, 但均为外生性肿瘤, 仍然可行机器人辅助腹腔镜右肾部分切除术。左肾影像学发现的3枚肿瘤, 均为完全内生型, 其中2枚位于肾门旁, 无法在体内原位行肾部分切除术。为能够同时达到切除肿瘤、保护肾脏及减少创伤三个目的, 我们设计了机器人辅助腹腔镜肾脏切取、离体低温工作台肾肿瘤切除及机器人辅助腹腔镜自体肾移植术。该术式只使用了一个腹部绕脐约6 cm切口, 既作为肾脏切取的取肾切口, 又作为机器人自体肾移植术的肾脏置入通道, 同时还利用该切口放置单切口PORT。一个切口多种用途, 减少了患者痛苦, 增加了该术式的合理性。
自体肾脏移植手术能否成功的关键在于术中维持肾脏低温。术中低温保护可有效减轻肾脏缺血再灌注损伤, 相比未降温手术, 术后肾功能明显改善[20, 22]。此外, 机器人吻合肾脏血管时间相对较长, 而术中维持肾脏低温可减轻术者压力, 提高血管吻合质量[23]。本例手术我们采用了Menon等[24, 25]为机器人辅助腹腔镜肾移植术设计的术中肾脏低温保护方法:①患者取头低脚高位, 使肠道远离盆腔; ②冰水浸湿纱布袋包裹移植肾并填塞冰屑; ③经腹部切口将肾脏放置于膀胱上方毗邻髂血管处; ④术中经腹部切口PORT向盆腔灌注冰屑维持肾脏低温。该方法降温效果好, 可持续维持肾脏表面温度于15~20℃, 已广泛应用于机器人辅助腹腔镜异体肾移植术。该方法不足之处在于:①纱布保温效果较差, 冰屑融化后冰水会流入腹腔, 不仅影响低温效果, 且增加术后麻痹性肠梗阻风险[26, 27]; ②需使用温度传感器监测肾表面温度; ③术中经切口PORT灌注冰屑易扩大降温范围, 影响核心体温, 而且可能会破坏气腹, 延长手术时间。为完善术中低温保护方法, Tuğ cu等[27]提出可填塞纱垫于盆腔吸收冰水, 减少术后肠梗阻的风险; Michiels等[28]建议改用塑料袋代替纱布填塞冰屑包裹移植肾, 避免了冰水渗漏, 还可通过观察冰屑融化程度估计肾脏温度。由于塑料袋保温效果优于纱布, 值得推广采用。此外, 如果术者手术经验丰富, 血管吻合时间短, 且冰袋内灌注足量冰屑, 无需术中再加灌冰屑。本例手术动静脉吻合时间共21 min, 明显短于国外报道[3, 4, 5], 肾脏血流开放后剪开纱布发现肾周冰屑并未完全融化, 肾脏仍处于冷缺血状态, 术中未再加灌冰屑, 术后移植肾功能恢复良好。
综上所述, 机器人辅助腹腔镜自体肾移植术联合体外低温工作台肾部分切除术可用于治疗多发复杂的孤立肾肿瘤或双肾肿瘤, 尤其适用于无法在体内完成保留肾单位手术的多发复杂肾肿瘤患者, 它既保留了患者肾脏, 又减轻了患者手术创伤及痛苦, 值得进一步探索及优化。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|