肾门部肿瘤, 指距离肾门处小于5 mm的肾脏肿瘤, 不论肿瘤的大小及是否突出于肾脏表面[1]。由于肾门部肿瘤位置特殊, 腹腔镜操作非常困难, 机器人因3D视野、仿手腕活动、坐姿操作等优点[2], 更加适合治疗肾门部等复杂位置肿瘤, 我们应用此方法治疗65例肾门部肿瘤取得满意效果, 报告如下。
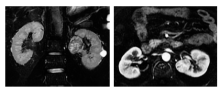
本组65例患者, 均为体检或偶然影像学检查发现肾脏肿瘤, 无临床症状。男42例, 女23例, 中位年龄51岁。体质指数中位数31.20 kg/m2。术前CT或MRI显示瘤体与肾门血管最近距离小于5 mm, 左侧肾占位39例, 右侧肾占位26例, 36例位于前唇、23例位于后唇、完全内生型6例(图1, 图2); 肿瘤平均大小:3.5 cm× 3.0 cm× 2.3 cm。
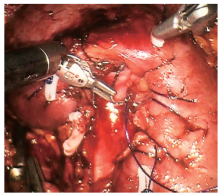
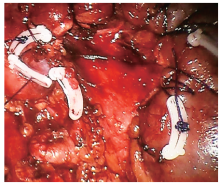
经腹腔途径:采用气管插管全身麻醉, 健侧45° 半斜卧位, 抬高腰部。da Vinci手术系统采用三臂。于脐斜上2 cm做一长约12 mm纵行皮肤切口用于机器人系统镜头孔, 置入镜头确认穿刺进入腹腔后, 保持气腹压1.596 kPa(12 mm Hg)。直视下, 以镜头孔为中心, 距锁骨中线肋缘下、髂前上棘内上方不少于两横指处分别置入8 mm Trocar, 为头侧、尾侧机械臂孔, 形成斜向镜头孔的倒等腰三角。镜头孔与尾侧机械臂孔连线中点斜下方置入12 mm常规Trocar为辅助孔, 形成斜向辅助孔的倒等腰三角形。将机旁机械臂手术系统按与患者背部垂直线头侧成15° 角移入位, 三臂与上述相应Trocar连接, 并分别置入镜头、单极弯剪、双极钳、吸引器或辅助器械。镜下观察腹腔内解剖结构, 于结肠旁沟切开侧腹膜, 并将结肠向内侧牵拉, 进入后腹腔, 分离后腹腔与肾周筋膜间隙。打开肾周脂肪囊后, 沿肾中部后方及腰大肌前缘游离至肾门处, 分离出肾动脉。置入无损伤血管夹, 阻断肾动脉。剪开肾被膜, 楔形切除肿瘤及部分肾组织, 临近肾门处紧贴血管壁将肿瘤完整切除, 必要时可用3-0可吸收线缝合肾盂, 用0号Quill可吸收线由内向外进针将肾实质创面锁边缝合(图3, 图4), 并用Hem-o-lok加固缝线。去除无损伤血管夹, 恢复肾脏血供, 若缝合创面有轻微渗血可用止血纱布压迫。
经后腹腔途经:采用气管插管全身麻醉, 健侧卧位。取患侧腋中线十二肋下至患侧髂嵴连线中点作为镜头孔, 置入镜头确认穿刺进入后腹膜间隙, 建立后腹膜间隙, 保持气腹压1.995 kPa(15 mm Hg)。钝性分离后腹膜间隙, 直视下于12肋缘下腋前线及腋后线分别置入8 mm Trocar为机械臂孔, 镜头孔与腋前线机械臂孔连线中点斜下方置入12 mm常规Trocar为辅助孔, 形成斜向辅助孔的倒等腰三角形。清理腹膜外脂肪, 打开肾周筋膜, 显露肾脂肪囊, 循患侧腰大肌前方向腹侧分离, 在肾中部找到肾动脉并游离, 顺肾长轴打开脂肪囊, 见肾门部肿瘤。用无损伤血管夹阻断肾动脉。剪开肾被膜, 楔形切除肿瘤及部分肾组织, 临近肾门处紧贴血管壁将肿瘤完整切除, 必要时可用3-0可吸收线缝合肾盂, 用0号Quill可吸收线由内向外进针将肾实质创面锁边缝合, 并用Hem-o-lok加固缝线。去除无损伤血管夹, 恢复肾脏血供, 若缝合创面有轻微渗血可用止血纱布压迫。置入取物袋, 将切除的标本取出体外。由髂嵴上穿刺处引出乳胶引流管。
65例手术均成功, 其中经后腹腔入路12例, 经腹腔入路53例, 低温灌注8例, 无中转开放手术。手术时间137 min(60~270 min, 包含机器人安装时间), 手术出血量64 ml(10~1 500 ml), 肾动脉阻断时间24.3 min(10~118 min), 术后引流管拔除时间3 d(1~21 d), 术后平均住院天数8.9 d, 未出现明显术后并发症。病理回报:肾透明细胞癌51例(Furman核分级Ⅰ ~Ⅲ 级), 乳头状肾癌3例, 血管平滑肌脂肪瘤7例, 囊性肾癌2例, 嗜酸性细胞瘤1例, 肾腺癌1例。无切缘阳性病例。随访32.6个月(1~96个月), 无转移、死亡、复发、漏尿等病例, 术后复查肾功能正常。
肾部分切除术是小肾癌治疗金标准, 其长期疗效与肾脏根治性切除术基本一致[3]。由于保留了更多的肾单位, 远期发生慢性肾功能不全及心血管疾病概率降低, 有报道指出肾部分切除术长期疗效甚至优于根治性肾切除术[4]。因此局限性肾癌只要技术上可行, 应首选肾部分切除术。肾门部肿瘤由于靠近肾脏主干血管及集合系统, 手术难度大, 术中肾动脉阻断时间长, 术后出血及尿漏等并发症发生率高, 有二次手术止血甚至切除患肾可能, 部分患者则接受了不必要的根治性肾切除术[5]。随着腹腔镜器械及技术改进, 腹腔镜肾部分切除术治疗肾门部肿瘤逐渐增多。尽管技术可行, 疗效满意, 但腹腔镜器械的局限性使得肾门部肿瘤操作困难, 只有腹腔镜技术经验丰富的医生才能开展此类手术。机器人手术系统具有灵活的机械特性、高清三维视野及智能除颤等技术优势, 为完成复杂肿瘤肾部分切除术提供了技术保障。
2000年第三代da Vinci机器人操作系统问世[6]。2004年, Gettman等[7]首先报道了13例机器人辅助腹腔镜下肾部分切除术, 其中8例采用肾动脉内置管冰盐水降温, 术后病理提示切缘均为阴性, 随访2~11个月无肿瘤复发。近年来国外机器人辅助腹腔镜肾门部肿瘤切除术的报道呈递增态势, Rogers等[8]报道了11例机器人辅助腹腔镜肾部分切除术治疗肾门部肿瘤的多中心研究, 平均肿瘤大小3.8 cm, 热缺血时间28.9 min, 平均手术时间202 min, 平均术后出血量220 ml, 术后eGFR绝对数下降8.0 ml· min-1· 1.73 m-2)。Eyraud等[9]报道了70例机器人辅助腹腔镜肾部分切除术治疗肾门部肿瘤, 与294例机器人辅助腹腔镜治疗非肾门部肿瘤进行对比分析, 结果显示非肾门部肿瘤在热缺血时间、手术时间、出血量等方面效果稍优于肾门部肿瘤, 但两者住院天数、术后并发症、切缘阳性率无差异。术后平均随访7.4个月, 肾门部肿瘤eGFR下降14.79%, 与非肾门部肿瘤eGFR下降10.1%相比差异无统计学意义。
尽管机器人辅助腹腔镜治疗肾门部肿瘤优势明显, 但术中仍需注意以下几点, ①手术路径选择:经腹腔路径几乎适用于所有部位肾脏肿瘤, 但对于肾脏背侧肿瘤及肾上极肿瘤, 经后腹腔路径不仅降低手术难度, 减少手术时间, 手术操作也更加便利。因此, 本组对肾脏腹侧肾门部肿瘤首选经腹腔路径, 肾脏背侧肾门部肿瘤首选经后腹腔路径(开始阶段一例背侧肾门部肿瘤采用经腹腔路径)。②降低切缘阳性率:首先充分游离肾脏, 根据肿瘤部位对肾脏进行相应摆放, 可用电钩勾勒出切除范围[10], 切除肿瘤应从肾门处开始, 有些肿瘤紧贴肾脏主干血管及集合系统表面, 过多切除周围组织, 有可能损伤主干血管及集合系统, 一旦血管及集合系统损伤过重, 肾脏有切除风险。这就要求既要完整切除肿瘤, 又要尽量保证主干血管及集合系统完整性, 此处可沿肿瘤包膜表面分离切除, 保证肿瘤包膜完整性即可。切除过程中, 肿瘤血管应随时结扎切断。③创面缝合:肾门部肿瘤切除后, 创面基底肾脏主干血管及集合系统裸露, 传统分二层缝合方法已不适用, 可采用全层连续锁边缝合, 由里向外进针进行缝合, 该方法手术时间短、操作简单、缝合对合平整、组织缝合层次少, 有利于原解剖结构的恢复, 降低活动性出血风险, 有效减少因缝入集合系统而导致肾盏狭窄的发生, 最大限度减少肾门处血管损伤可能。运用以上方法, 65例手术均成功, 无中转开放手术。手术平均时间137 min, 手术平均出血量64 ml, 肾动脉平均阻断时间24.3 min, 与国外文献报道[11~13]相比, 手术时间、手术出血量、热缺血时间方面均减少。无切缘阳性病例, 随访32.6个月, 无转移、死亡、复发、漏尿等情况发生。
综上所述, 机器人辅助腹腔镜肾门部肿瘤切除术安全、可靠, 值得进一步推广应用。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|