腹腔镜微创手术已成为泌尿外科常规的手术方式, 尤其是机器人辅助腹腔镜技术成熟应用后, 手术微创化与尖端工业产品相融合, 目前已成为泌尿外科发展最迅猛的手术方式之一。自2004年Gettman等首次报道机器人辅助腹腔镜肾部分切除术(robot-assisted laparoscopic partial nephrectomy, RALPN)以来[1], da Vinci机器人手术系统成为肾部分切除的新选择, 其优良的机械性能使腹腔镜肾部分切除术手术适应证不断拓展。我科自2015年2月装机以来, 机器人辅助腹腔镜手术迅速应用于泌尿系统各手术领域, 至2016年6月单术者已完成机器人辅助腹腔镜肾部分切除术85例, 疗效满意, 现报告如下。
本组85例, 其中男57例, 女28例, 平均55(9~73)岁。85例患者均为健康体检发现病灶, CT增强、MR或超声造影诊断肾占位, 考虑肿瘤性病变。肿瘤大小平均2.7 cm× 3.8 cm(1.0 cm× 2.0 cm~9.0 cm× 10.0 cm)。
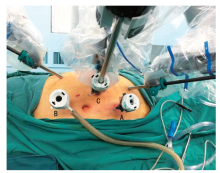
麻醉满意后, 患者取健侧斜卧位, 依患者体型倾斜45~75° , 抬高腰桥以暴露肋弓与髂棘间的腹部间隙, 术野常规消毒铺巾, 以患侧脐上2 cm腹直肌外缘作为镜头孔穿刺点, 留置12 mm Trocar进入腹腔, 注入CO2气体保持气腹压1.596 kPa(12 mm Hg), 以30° 上置入镜头, 以肋弓下腹直肌外缘距镜头孔8~10 cm处为头侧机械臂Trocar穿刺点, 以髂前上棘内侧距镜头孔8~10 cm处为尾侧机械臂Trocar穿刺点, 以两机械臂Trocar穿刺点与镜头孔连线中点分别做垂直线, 其与腹正中线交点作为头侧及尾侧辅助孔Trocar穿刺点, 在30° 上镜头直视下通过上述穿刺点置入Trocar。将床旁机械臂系统移动入位, 机械臂分别与镜头、头侧及尾侧机械臂Trocar连接, 镜头直视下置入单极电剪及双极抓钳, 调整器械进入腹腔内手术野中央位置, 辅助孔分别置入吸引器及肠钳等辅助器械(图1)。如患侧为右侧, 肿瘤位于肾上极受肝脏影响视野时, 可取剑突下留置5 mm Trocar协助举肝。调整镜头30° 下并固定, 纵向切开结肠旁沟, 以输尿管、生殖血管等为解剖标记, 仔细游离肾蒂, 暴露肾脏动静脉主干。以术前影像资料为参考, 游离肾周脂肪, 暴露占位及周边正常肾组织, 仔细辨认肿瘤边界, 如为内生型肿瘤则借助术中超声指引准确定位肿瘤范围。无损伤“ 哈巴狗钳” 阻断肾动脉后, 剪刀沿肿瘤边缘正常肾组织(约0.5 cm处或紧贴肿瘤包膜外缘)完整切除肿瘤, 用3-0 Quill 可吸收线沿创面基底部缝合以闭合剪开的静脉系统及集合系统, 以2-0 Quill 可吸收线缝合肾实质创面, 缝合线收紧后以Hem-o-lok妥善固定, 取出“ 哈巴狗钳” 恢复肾脏血供, 仔细检查术野无活动性出血, 标本袋取出切除标本, 留置引流管后, 解除Trocar与机械臂连接, 拔出所有Trocar, 分别缝合伤口, 术毕。
85例患者均完成腹腔镜下肾部分切除术, 无改变手术方式病例; 手术时间(不包括机械臂准备时间)65~128 min, 肾动脉阻断时间9~33 min, 术中出血10~450 ml; 术后3~5 d下床活动, 4~5 d拔除引流管, 术后住院时间5~10 d。术后病理报告透明细胞癌70例, 血管平滑肌脂肪瘤7例, 乳头状肾细胞癌4例, 嫌色细胞瘤2例, 嗜酸性细胞瘤1例, 肾孤立性纤维瘤1例, 无切缘阳性病例。1例患者术后第2天出血行介入栓塞术, 术后第10天正常出院。随访3~16个月, 无局部复发及远处转移病例, 术后CT增强及肾ECT复查, 患侧肾功能均保持术前相仿水平。
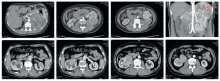
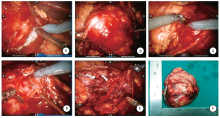
常见的肾癌类型进展多较缓慢, 其侵袭转移潜能大多较低, 因此手术完整去除病灶是肾肿瘤的关键治疗方式[2]。随着高精度的超声系统在日常体检中的广泛应用, 约70%的肾癌为无症状偶然发现, 其瘤体大多局限于肾包膜内, 而保留肾单位手术在此类局限性肾癌患者中应用越来越广泛[3, 4]。机器人辅助腹腔镜肾部分切除术的手术适应证与传统腹腔镜大体相同, 一般认为肿瘤直径< 4 cm的cT1期为手术适应证, 但随着手术技巧的进步, 直径7 cm以下肾肿瘤的保留肾单位手术也有成熟应用[5], 尤其是机器人手术系统应用后, 由于其在剪切及缝合上的灵活性, 为肾热缺血时间(warm ischemia time, WIT)留有余量, 从而便于处理巨大占位、多发占位及复杂部位占位, 使肾部分切的手术适应证进一步扩大, 如本组85例患者中, 有5例患者肿瘤直径大于7 cm, 由于双侧肾占位、解剖性/功能性孤立肾等原因, 患者需优先选择保留肾单位手术(图2)。对于巨大肾占位肾部分切除术, 除肿瘤占位效应导致的剪切及缝合挑战外, 如何在保持肿瘤切缘阴性同时尽可能多保留功能肾单位也是关键问题。随着手术技巧提高及适应证扩大, 肾部分切除时肿瘤切除范围的讨论一直是临床关注的问题。传统观点多强调距离占位5~10 mm进行剪切, 但目前观点多认为术中保持肿瘤包膜完整即可达到切缘阴性的要求[6], 而且研究表明, 尽管WIT是术后患者肾功能保留的关键因素, 但术后半年患侧肾功能保存与WIT关联性不显著, 而保留的功能肾单位数量却在术后半年明显影响患侧肾功能水平[7], 因此尽可能保留多的正常肾组织对患者肾功能保持意义重大, 这一点在占位较大的肾部分切除术中尤为关键, 术者认为, 在机器人手术处理较大肾占位时, 借助肿瘤与正常肾组织切迹明显处或术中超声定位先行锐性切开, 剪切开始时宁浅勿深, 确保肿瘤完整, 仔细辨认肿瘤的假性包膜, 然后应用双极抓钳钝性头端仔细推挤肿瘤组织, 从而沿肿瘤包膜外缘“ 剥离” 肿瘤(图3), 当占位较大推挤肾盂或肾蒂主干血管时, 借助机器人系统高清稳定的视野, 沿包膜“ 剥离” 肿瘤尤为重要, 可最大限度保持肾盂及脉管系统完整性及减少术中出血。
自美国Mayo医学中心于2004年首次报道应用机器人手术系统行肾部分切除术以来, 国内外关于机器人辅助手术与传统腹腔镜手术的比较多有报道[8~10], 结论普遍认为, 机器人辅助手术在手术时间、WIT、术中失血、术后并发症等方面数据优于传统腹腔镜, 但不同文献对于两者上述参数的统计学差别报道不一, 上述差别可能与术者操作机器人及传统腹腔镜熟练程度, 肾肿瘤复杂程度有关; 就本报道单术者经验, 机器人辅助腹腔镜手术学习曲线较短, 熟悉操作后术者可以迅速达到自身传统腹腔镜手术水平, 由于机器人系统提供的高清视野, 稳定的镜头配合及灵活的器械操作, 在时间等相关手术参数上机器人手术明显占优; 但就常规占位情况(肿瘤直径< 4 cm, 瘤体大部突出于肾脏, 瘤体周围解剖结构简单清晰等), 机器人手术对于传统腹腔镜并未发挥最大优势, 因此常有报道手术参数统计无明显差别; 但对于特殊类型肾占位的情况, 如较大肾占位(直径> 7 cm, 本报道多例患者占位直径达10 cm)、多发占位、复杂部位占位(HUS部位)等, 机器人辅助腹腔镜手术优势明显, Benway等[11]分析了肾肿瘤复杂程度对于机器人辅助腹腔镜手术及传统腹腔镜手术的影响, 发现机器人辅助手术在手术时间及失血量等数据上未受肿瘤复杂程度影响, 而传统腹腔镜上述参数明显延长, 而且机器人手术组WIT明显优于传统腹腔镜。术者也有类似经验, 当占位较大或多发时, 传统腹腔镜手术常需面对视野无法持久稳定、操作不便利等问题, 手术时间及WIT明显延长, 而机器人手术时, 由于视野稳定、狭窄腔隙操作灵活等, 处理特殊类型肾占位时明显优于传统腹腔镜, 尤其是肾蒂后唇近脊柱处, 瘤体横跨肾脏腹侧及背侧(HUS部位)的肿瘤行肾部分切时, 传统腹腔镜手术极难完整暴露肿瘤, 剪切肿瘤常易误伤肾蒂血管或无法完整切除病灶, 肿瘤切除创面难以在视野直视下缝合, 常不得已中转开放手术, 而机器人辅助腹腔镜在完整游离肾脏后, 通过稳定的镜头及机械臂的灵活操作对肾蒂进行旋转从而暴露肿瘤, 使腹腔镜下处理HUS部位肿瘤的肾部分切成功率大为提高。
综上所述, 尽管机器人辅助腹腔镜手术目前费用仍较高, 其成本效益仍存争议, 但机器人辅助腹腔镜肾部分切除术手术操作精细便利, 手术操作熟练术者实行此术式明显优于传统腹腔镜手术。机器人手术拓展了腹腔镜肾部分切的手术适应证, 对于较大、多发或复杂部位占位等特殊类型肾部分切除术应作为优先选择。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|